
| A. | Mg 和 Ag | B. | Mg和 Al | C. | Cu和 Zn | D. | Fe 和 Zn |
分析 假设金属都为+2价,根据M=$\frac{m}{n}$计算金属混合物的平衡相对原子质量,利用平均值法判断,若金属不与盐酸反应,其相对原子质量看作无穷大.
解答 解:11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,则金属混合物的平均相对原子质量为$\frac{15}{0.5}$=30,
A.Mg的相对原子质量为24,Ag与盐酸不反应,相对原子质量看作无穷大,符合题意,故A正确;
B.Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为$\frac{2}{3}$×27=18,平均值介于18~24之间,小于30,故B错误;
C.Zn的相对分子质量为65,Cu与盐酸不反应,相对原子质量看作无穷大,不符合题意,故C错误;
D.Zn的相对分子质量为65,Fe的相对原子质量为56,平均值大于30,故D错误;
故选A.
点评 本题考查混合物的计算,难度中等,理解平均值法运用,注意化合价与相对原子质量的关系,注意金属不与盐酸反应,其相对原子质量看作无穷大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b | |
| B. | 常温下,浓度均为0.1mol/L ①醋酸、②盐酸、③醋酸钠溶液,水的电离程度由大到小的顺序为:③>①>② | |
| C. | 物质的浓度相同的:①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH由大到小的顺序为:③>①>② | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
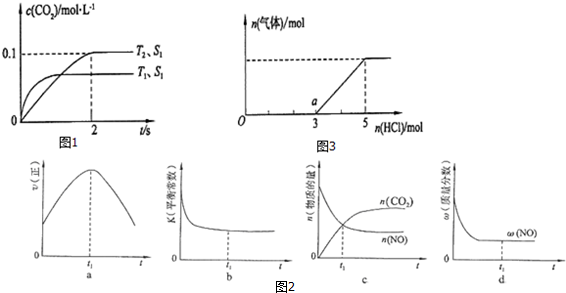
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com