
| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
分析 A.石蕊试液在pH值小于5时呈红色,大于8时呈蓝色;甲基橙在pH值小于3.1时呈红色,大于4.4时呈黄色;
B.加入氯化铜后氯离子和铜离子放电;
C.由于氢氧化钠分子量小,所以按氢氧化钠计算会导致氢氧根偏少.最后滴定量就会减多,导致结果偏高;
D.电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时电极附近生成氢氧根离子,无色酚酞遇碱变红色,根据电极附近氢氧根离子浓度变化来分析解答.
解答 解:A.石蕊试液在pH值小于5时呈红色,大于8时呈蓝色;甲基橙在pH值小于3.1时呈红色,大于4.4时呈黄色,溶液的pH值:4.4<PH<5,故A正确;
B.加入氯化铜后氯离子和铜离子放电,水不电解,故B错误;
C.因为氢氧化钠的相对分子质量小于氢氧化钾,滴定液的实际氢氧根离子浓度小于要配制的标准溶液的浓度.造成消耗酸的量更少,测定的盐酸溶液浓度的结果比实际的要大,故C正确;
D.电解饱和食盐水时,阳极上氯离子失电子发生氧化反应而生成氯气,阴极上氢离子得电子发生还原反应而生成氢气,同时阴极附近生成氢氧根离子,则阴极附近氢氧根离子浓度增大,无色酚酞遇碱变红色,所以阴极区域溶液先变红色,故D正确.
故选B.
点评 本题考查了常见指示剂石蕊、甲基橙的变色范围、电解原理、溶液配制等,难度较大,注意溶液配制实验中药品不纯对实验结果的影响.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题


 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
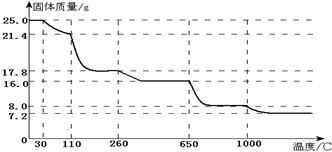
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
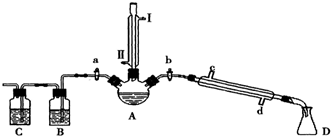
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com