

分析 E、X常温下为无色无味气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,据此解答.
解答 解:E、X常温下为无色无味气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,
(l)B为NaOH,含有离子键、共价键,故答案为:离子键、共价键;
(2)常温常压下,7.8g Na2O2与足量的水充分反应放出热量a kJ,2mol Na2O2完全反应方程式的热量=a kJ×$\frac{2mol×78g/mol}{7.8g}$=20a kJ,反应热化学方程式为:2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol,
故答案为:2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol;
(3)碳酸钠也可转化为氢氧化钠,该转化的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比=3:2,所以溶液中还存在NaOH,说明原溶液中为NaOH、Na2CO3,结合方程式可知,溶液中n(NaOH):n(Na2CO3)=1:2,故a点是氢氧化钠恰好与盐酸反应碳酸钠未反应,a点时溶液中的溶质是Na2CO3和NaCl,
b点时,碳酸钠恰好转化为碳酸氢钠,b点溶液中的溶质是NaHCO3和NaCl,且n(NaHCO3):n(NaCl)=2:3,钠离子和氯离子不水解,根据元素守恒知c(Na+)>c(Cl-)>c(HCO3-),NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),
故答案为:Na2CO3和NaCl;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(5)①F是BaCO3,温度不变,溶度积常数不变,溶液中c(Ba2+)≈0.5mol/L,则溶液中c(CO32-)=$\frac{2.5×10{\;}^{-9}}{0.5}$mol/L=5×10-9mol/L,
故答案为:不变;5×10-9;
②已知25℃时硫酸钡的Ksp=1.0×10-10,若向20mL硫酸钡的饱和溶液中逐滴加入8.0×10-4mol/L的Na2CO3溶液20mL,混合后溶液中c(Ba2+)≈$\frac{1}{2}$×$\sqrt{1.0×10{\;}^{-10}}$mol/L=5.0×10-6mol/L,则溶液中c(CO32-)=$\frac{1}{2}$×8.0×10-4mol/L=4.0×10-4mol/L,而5.0×10-6×4.0×10-4=2.0×10-9<2.5×10-9,故没有沉淀产生,
故答案为:否.
点评 本题考查了无机物推断,涉及化学键、热化学方程式、离子浓度大小比较、溶度积有关计算等知识点,(4)为易错点,清楚发生的反应判断原溶液中溶质及物质的量关系是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用烧碱溶液消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH═NaNO2+H2O | |
| B. | 制硝酸铜:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | |
| C. | 制甲基丙烯酸甲酯(即有机玻璃): | |
| D. | 制硫酸铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低 $\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 17g NH4+中含有的质子数为11NA | |
| C. | 46 g NO2和N2O4混合气体中含有的原子总数为3 NA | |
| D. | 1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
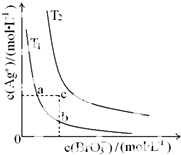
| A. | T1>T2 | |
| B. | 加入AgNO3固体,可使a点变到c点 | |
| C. | a点和b点的Ksp相等 | |
| D. | c点时,在T1、T2两个温度下均有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时Kw=10-12 | |
| B. | 加热蒸干后无任何残留物 | |
| C. | 常温100g该液体中最多溶解NaCl固体36g | |
| D. | 常温下,阳离子总浓度c=10-7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com