
【题目】25℃时,将 0.10 molL-1的NaOH溶液逐滴滴入到20.00 mL 0.10 mol L-1醋酸溶液中,溶液中的pH曲线与NaOH溶液体积的关系如图所示:

下列有关判断错误的是( )
A. 该温度下,醋酸的Ka的数量级为l0-5 B. N点对应的NaOH溶液体积可能为20.0mL
C. 溶液中,水的电离程度N点比Q点大 D. R点所示溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】D
【解析】A、开始时,醋酸的pH=3,Ka=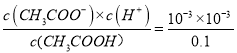 =10-5,故A说法正确;B、醋酸是弱酸,M点溶液的pH=7,此时的溶质为CH3COOH和CH3COONa ,N点溶液的pH=9,需要继续加入NaOH,当两者恰好完全反应时,溶质为CH3COONa,溶液显碱性,消耗的NaOH的体积可能为20.00mL,故B说法正确;C、N点溶质CH3COONa,促进水的电离,Q点是溶质为CH3COONa和NaOH,抑制水的电离,因此N点水的电离程度大于Q点,故C说法正确;D、不遵循电荷守恒,R点溶液显酸性,溶质为CH3COOH和CH3COONa,因为溶液显酸性,因此CH3COOH的电离程度大于CH3COO-水解程度,即离子浓度大小顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D说法错误。
=10-5,故A说法正确;B、醋酸是弱酸,M点溶液的pH=7,此时的溶质为CH3COOH和CH3COONa ,N点溶液的pH=9,需要继续加入NaOH,当两者恰好完全反应时,溶质为CH3COONa,溶液显碱性,消耗的NaOH的体积可能为20.00mL,故B说法正确;C、N点溶质CH3COONa,促进水的电离,Q点是溶质为CH3COONa和NaOH,抑制水的电离,因此N点水的电离程度大于Q点,故C说法正确;D、不遵循电荷守恒,R点溶液显酸性,溶质为CH3COOH和CH3COONa,因为溶液显酸性,因此CH3COOH的电离程度大于CH3COO-水解程度,即离子浓度大小顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D说法错误。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:_______________________________________。
(2)KHSO4:________________________________________。
(3)HNO3:_________________________________________。
(4)Na2CO3:_______________________________________。
(5)NaHCO3:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“漂粉精”Ca(ClO)2与密度为1.19g·cm-3质量分数为36.5%的HCl溶液反应生成Cl2,该化学方程式为:Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑ + 2H2O
(1)浓盐酸在反应中显示出来的性质是____________ (填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥法表示该氧化还原反应中电子转移情况_________________。
(3)标准状况下若产生4.48L Cl2,则反应过程中被氧化的HCl的物质的量是___。
(4)某同学欲用该浓盐酸配制100mL1mol·L﹣1HCl溶液.回答下列问题:
①需取用该浓盐酸体积为________。
②配制1mol·L﹣1HCl溶液时需用的主要仪器有烧杯、量筒、玻璃棒、胶头滴管、___。
③不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响偏小的是__。(请填序号)
A.容量瓶中原有少量蒸馏水 B.定容时俯视刻度线
C.玻璃棒在刻度线上方引流溶剂水 D.颠倒摇匀后发现凹液面低于刻度线但没加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用纯溴和苯在铁离子催化下反应制取溴苯,得到粗溴苯后,粗溴苯的精制常进行如下操作:a.蒸馏 b.水洗、分液 c.用干燥剂干燥 d.10%的NaOH溶液碱洗、分液。正确的操作顺序是 ( )
A.abcdbB.bdbcaC.dbcabD.bdabc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A. ①④ B. ①④⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、锌在农药、材料和人们日常生活中具有广泛的应用。请回答下列问题:
(1)基态S原子中,核外电子占据的最高能级符号为______,其电子云形状为______,基态Zn原子的价电子排布式为______。
(2)硫代乙酰胺(CH3CSNH2)在酸性溶液中水解产生H2S,可替代H2S在溶液中作沉淀剂使用。1 mol CH3CSNH2含有π键为______mol,其中两个C原子的杂化方式分别为_______。
(3)H2S熔点为-85.5℃,而与其具有类似结构的H2O的熔点为0℃,极易结冰成固体,二者物理性质出现此差异的原因是____________________。
(4)ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。晶胞结构如图所示:

在一个ZnS晶胞结构中,S的数目为 ______。若该晶胞边长为540.0 pm,则其密度为_______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A. 半导体材料砷化镓 B. 透明陶瓷材料硒化锌
C. 吸氢材料镧镍合金 D. 超导材料K3C60
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com