
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72−和CrO42−,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72−的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是_______________________________。
(2)阴极附近溶液pH升高的原因是_______________________________(用电极反应式解释);溶液中同时生成的沉淀还有________________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
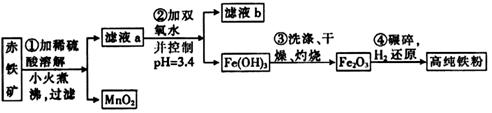
已知:①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(3)步骤②中加双氧水的目的是_________________________,pH控制在3.4的作用是_____________________________;已知25℃时,Ksp[Cu(OH)2]=2.0×10-20,该温度下反应:Cu2++2H2O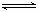 Cu(OH)2+2H+的平衡常数K=_______________。
Cu(OH)2+2H+的平衡常数K=_______________。
(4)制备氮化铁的反应:Fe+NH3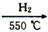 FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)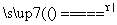 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
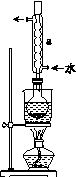
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O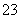 +I2===S4O
+I2===S4O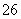 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
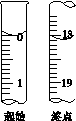
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO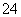 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列情况能发生消去反应的是( )
A.1-溴丙烷与NaOH醇溶液共热
B.氯乙烷与NaOH的水溶液共热
C.乙醇与浓H2SO4共热至140℃
D.乙醇与浓H2SO4共热至170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
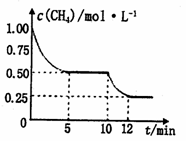
在密闭容器中进行反应CH4(g)+H2O(g)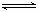 CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示,下列判断正确的是
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示,下列判断正确的是
A.10 min时,改变的外界条件可能是减小压强
B.0~5 min内,v(H2)=0.1 mol/(L·min)
C.恒温下,缩小容器体积,平衡后c(H2)减小
D.12 min时,反应达平衡,气体的平均摩尔质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列文字表述与反应方程式对应且正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+===2Fe3++3H2O
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:
HCO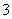 +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO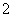 +4NH
+4NH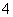 +2H2O
+2H2O
D.硫化钠水溶液呈碱性:S2-+H2O HS-+OH-
HS-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子 组在一定条件下能共存
组在一定条件下能共存 ,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发 |
| A | Fe2+、NO | 稀硫酸 | 3Fe2++NO |
| B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=== Fe(OH)3↓ |
| C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
| D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3OH-=== Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
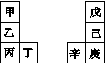
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素及其化合物的说法正确的是( )
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
C.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com