

分析 氯化钠转化得到A、B,二者又得到NaCl,B与Fe反应生成D,则A为Na、B为Cl2,D为FeCl3,Na与水反应生成C,C与FeCl3反应生成NaCl,故C为NaOH,C与二氧化碳反应生成E,氯化铁与氢氧化钙反应生成F,E与F反应又生成NaCl,故E为Na2CO3、F为CaCl2,据此解答.
解答 解:氯化钠转化得到A、B,二者又得到NaCl,B与Fe反应生成D,则A为Na、B为Cl2,D为FeCl3,Na与水反应生成C,C与FeCl3反应生成NaCl,故C为NaOH,C与二氧化碳反应生成E,氯化铁与氢氧化钙反应生成F,E与F反应又生成NaCl,故E为Na2CO3、F为CaCl2.
(1)根据上述分析可知,B为Cl2,D为FeCl3,E为Na2CO3,故答案为:Cl2;FeCl3;Na2CO3;
(2)①C+D→NaCl反应的化学方程式:3NaOH+FeCl3=3NaCl+Fe(OH)3↓;
②E+F→NaCl反应的化学方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl,
故答案为:3NaOH+FeCl3=3NaCl+Fe(OH)3↓;Na2CO3+CaCl2=CaCO3↓+2NaCl.
点评 本题考查无机物推断,比较基础,需要学生熟练掌握元素化合物知识,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 2.5×1022个 | B. | 2.5×1019个 | C. | 5×1022个 | D. | 5×1019个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
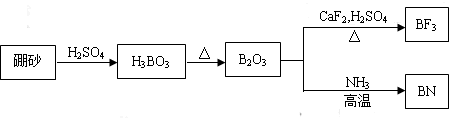
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com