
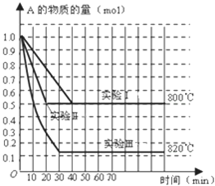
 在一密闭容器中发生化学反应:2A(g)?B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法正确的是( )
在一密闭容器中发生化学反应:2A(g)?B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法正确的是( )| A、该反应正反应为放热反应 | B、实验Ⅱ和实验Ⅰ比较,实验Ⅱ一定使用了催化剂 | C、在实验Ⅰ中,若容器的体积为0.5L,则从开始到达平衡时间内B的平均反应速率为0.025mol/(L?min) | D、在800℃时,增大压强,若反应重新达平衡时混合气体对氢气的相对密度为64.5,则A的相对分子质量为129 |
| 1mol-0.5mol |
| 0.5L |
| △c |
| △t |
| 1mol-0.5mol |
| 0.5L |
| 0.5mol/L |
| 40min |
| 1mol×MA |
| (0.5mol+0.25mol+0.25mol) |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:阅读理解
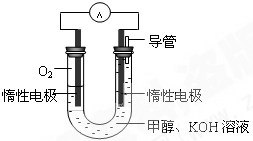 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| C4(NO2)C(O2) |
| C2(N2O5) |
| C4(NO2)C(O2) |
| C2(N2O5) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
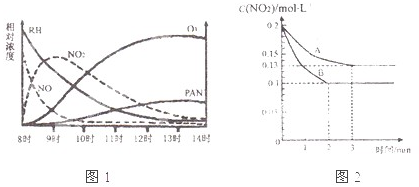
(15分)控制,治理氮氧化物对大气的污染是改善大气质量的重要方法。
(1)某研究性学习小组在一烟雾实验箱中对光化学烟雾形成进行了模拟实验。测得烟雾的主要成分为C2H8(烃)、NO2、O3、PAN(CH3COOONO2)各种物质的相对浓度随时间的变化,记录于右图。根据图中数据,下列推论中合理的是 (填写序号)
A.NO的消耗的速率比CxHy快
B.C2H8和NO2反应可以生成PAN及O2
C.CxHy与O3反应生成PAN
(2)火力发电厂的燃煤排烟中含大量的氮氧化物(NO![]() ),可利用甲烷和NO
),可利用甲烷和NO![]() 在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为 。
在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为 。
(3)在一密闭容器中发生反应2NO22NO+O3;△H>0,反应过程中浓度随时间变化的情况如下图所示。
请回答:
①图中表示NO2的变化的曲线是 。用O2表示从O—10s内该反应的平均速率v(O2)= 。
②能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
③第13秒钟时,改变实验条件(温度、压强、催化剂)得到温度随时间变化的曲线,则第13秒钟改变的条件是 ;
(4)一定温度下,在恒容密闭容器中N2O3可发生下列反应:
(Ⅰ)2N2O5(g)4NO2(g)+O2(g)
(Ⅱ)2NO2(g) 2NO(g)+O2(g)
若达到平衡时,c(NO2)=0.4mol·L-1,c(O2)=1.3mol·L-1,则反应Ⅱ中NO2的转化率为 。N2O5(g)的起始浓度应不低于 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com