
| A、达到平衡时,SO2的浓度与SO3的浓度相等 |
| B、相同状况下,反应2SO3(g)?2SO2(g)+O2(g)是一个吸热反应 |
| C、在密闭容器中加入2molSO2和1molO2充分反应后放出197KJ的热量 |
| D、升高温度,吸热反应的速率增大,放热反应的速率减少 |


科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
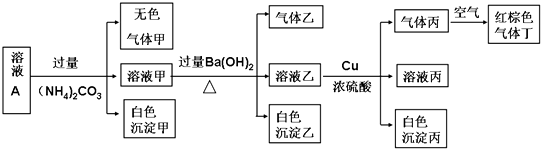
| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中难以确定Cl-的存在与否 |
| B、原溶液中所含的离子为:Fe2+、K+、NO3-、SO42- |
| C、步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子是否存在 |
| D、步骤③中的白色沉淀为2种钡盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取5.2mL盐酸 |
| B、用pH试纸测得某溶液的pH值为12.5 |
| C、用托盘天平称取25.12gNaCl固体 |
| D、用100mL容量瓶配制50mL0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C<N<O |
| B、非金属性:Si>P>S |
| C、稳定性:SiH4>PH3>H2S |
| D、酸性强弱:H2SiO3<H3PO4<H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com