
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① Na Na |
② Cl Cl |
0 |
| 原子结构示意图 | 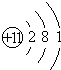 |
③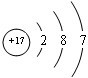  |
④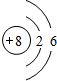 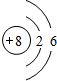 |
| 周期 | 三 | 三 | ⑤ 二 二 |
| 族 | ⑥ ⅠA ⅠA |
ⅦA | ⑦ ⅥA ⅥA |
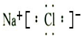
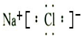
 ;
;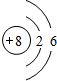 ,
,| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ①Na | ②Cl | 0 |
| 原子结构示意图 | 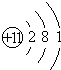 |
③ |
④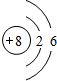 |
| 周期 | 三 | 三 | ⑤二 |
| 族 | ⑥ⅠA | ⅦA | ⑦ⅥA |
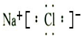 ,故答案为:
,故答案为: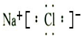 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① Na Na |
② Cl Cl |
O |
| 原子结构示意图 | 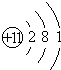 |
③  |
④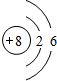 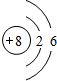 |
| 周期 | 三 | 三 | ⑤ 二 二 |
| 族 | ⑥ IA IA |
ⅦA | ⑦ VIA VIA |
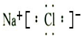
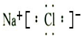
查看答案和解析>>
科目:高中化学 来源: 题型:
| c[Ba(OH)2]/mol?L-1 | c[NaHSO4]/mol?L-1 | c[NaHCO3]/mol?L-1 |
1.8 1.8 |
1.8 1.8 |
0.9 0.9 |
1.8 1.8 |
0.9 0.9 |
1.8 1.8 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省高三第二次毕业生复习统一检测(理综)化学部分 题型:实验题
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置及尾气处理过程均略去)并回答:
(1)如图所示,通入C12—段时间后,观察A、B、C三个棉球的变化,并补充完成下表所示的实验报告。
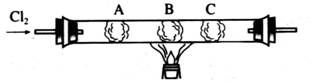
|
实验内容 |
实验现象[来源:Zxxk.Com] |
解释或结论 |
|
|
棉 球 |
棉球上滴加试剂 |
||
|
A |
KBr溶液 |
棉球变为___________色 |
化学方程式:__________ |
|
B |
_____溶液 |
棉球变为棕黄色 |
离子方程式:__________ |
|
C |
淀粉溶液 |
①棉球变为蓝色; ②待试管冷却后,在B、C之间的玻璃壁上有_____ 色固体产生 |
②的原因:__________ |
(2)实验室里,氯气通常用浓盐酸和二氧化锰在加热的条件下制取,该反应的化学方程
式为______________________________,此外还可以用高锰酸钾、氯酸钾等氧化剂与浓盐酸在常温下反应制取。某化学课外活动小组用如图所示的装置制取氯气并模拟盐酸工业合成氯化氢(金属网用以防止气体在燃烧过程中发生爆炸)。
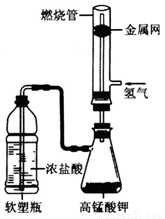
实验过程如下:
步骤一:先通入氢气,验纯后点燃;
步骤二:待氢气稳定燃烧后,挤压软塑瓶,将浓盐酸加入锥形瓶中,氢气持续安静燃烧。
请回答:
①步骤二完成后,火焰的颜色由淡蓝色变为__________色,燃烧管的上方可观察到_____现象;
②先通氢气并点燃,再通氯气的原因是_______________
③采用外管通氢气、内管通氯气的目的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置及尾气处理过程均略去)并回答:
(1)如图所示,通入C12—段时间后,观察A、B、C三个棉球的变化,并补充完成下表所示的实验报告。
| 实验内容 | 实验现象 | 解释或结论 | |
| 棉 球 | 棉球上滴加试剂 | ||
| A | KBr溶液 | 棉球变为___________色 | 化学方程式:__________ |
| B | _____溶液 | 棉球变为棕黄色 | 离子方程式:__________ |
| C | 淀粉溶液 | ①棉球变为蓝色; ②待试管冷却后,在B、C之间的玻璃壁上有_____ 色固体产生 | ②的原因:__________ |
(2)实验室里,氯气通常用浓盐酸和二氧化锰在加热的条件下制取,该反应的化学方程
式为______________________________,此外还可以用高锰酸钾、氯酸钾等氧化剂与浓盐酸在常温下反应制取。某化学课外活动小组用如图所示的装置制取氯气并模拟盐酸工业合成氯化氢(金属网用以防止气体在燃烧过程中发生爆炸)。
实验过程如下:
步骤一:先通入氢气,验纯后点燃;
步骤二:待氢气稳定燃烧后,挤压软塑瓶,将浓盐酸加入锥形瓶中,氢气持续安静燃烧。
请回答:
①步骤二完成后,火焰的颜色由淡蓝色变为__________色,燃烧管的上方可观察到_____现象;
②先通氢气并点燃,再通氯气的原因是_______________
③采用外管通氢气、内管通氯气的目的是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com