
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
科目:高中化学 来源: 题型:
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
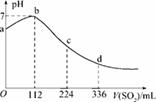 A.ab段反应是:SO2+2H2S===3S↓+2H2O
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol-1
② H2O(l) H2O(g) △H= + 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g) |
| 方法二 | CO2(g) +3H2(g) |
工业上可用如下方法合成甲醇:
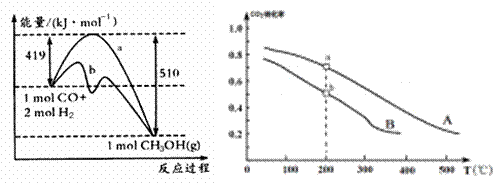
方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的
倍(保留两位小数).
甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | ||||||||||||||||||
| ② | ③ | |||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | |||||||||||||||
| ⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区元素的是 (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见
溶剂的化学式为 ,其立体构型为________________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与
元素①所形成化合物的水溶液显 性(填“酸”或“碱”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为 。
(6)元素⑩的基态原子核外电子排布式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.已知2NO2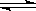 N2O4加压后颜色先变深后变浅。
N2O4加压后颜色先变深后变浅。
B. 在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
C.在密闭容器中进行如下反应:X2(g)+Y2(g) 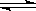 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
D. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是⑤⑥⑦⑧。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有什么试剂的洗气瓶
A.澄清石灰水、浓H2SO4 B.KMnO4酸 性溶液、浓H2SO4
性溶液、浓H2SO4
C.溴水、浓H2SO4 D.浓H2SO4、KMnO4酸性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项内容中,排列顺序正确的是
① 固体的热稳定性:Na2CO3>NaHCO3
② 相同物质的量浓度的下列溶液中NH4+ 的浓度:
(NH4)2SO4>(NH4)2CO3>NH4Cl
③ 微粒半径:K+>S2->F
④ 给出质子的能力:CH3COOH>C2H5OH>H2O
⑤ 氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com