
| A. | 常温常压下,71g Cl2中所含分子数为NA | |
| B. | 0.1mol/L的H2SO3溶液中,c(H+):c(SO32-)>2:1 | |
| C. | 2L 0.6mol/L的Fe2(SO4)3溶液中,含Fe3+离子总数为2.4NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于稀盐酸中 2Fe+6H+═2Fe3++H2↑ | |
| B. | 钠和水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4与N2互为同位素 | |
| B. | N4H44+与NaOH溶液反应的离子方程式为N4H44++4OH-═N4+4H2O | |
| C. | N4H4(SO4)2为弱电解质 | |
| D. | N4H44+中只含有极性共价键,不含非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1 FeCl3溶液中加入0.1 mol•L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.5g金属Zn与过量的硫酸反应,硫酸无论浓稀,转移电子数均为0.2Na | |
| B. | 含有1mol FeCl3的溶液中阴离子数等于3NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | Na2S和Na2O2 固体混合物15.6g中,含有的阴离子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NO3-、OH-、Cl- | B. | Cu2+、SO42-、H+、Na+ | ||
| C. | H+、Ba2+、Mg2+、NO3- | D. | NH4+、MnO4-、H+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的结构简式为CH3CH2CH2CH3 | B. | 一氯乙烷的结构式为CH3Cl | ||
| C. | 四氯化碳的电子式为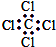 | D. | 苯的分子式为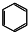 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
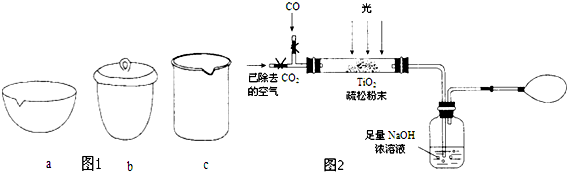
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com