
| A. | a=b | B. | a<b | C. | a>b | D. | 不能确定 |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-═NH3•H2O | |
| D. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的白色沉淀不一定是BaSO4 | |
| D. | 此实验不能确定Na2SO3是否部分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
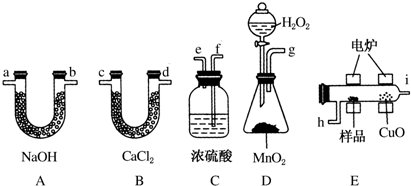
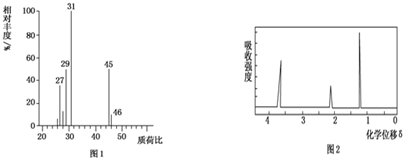
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
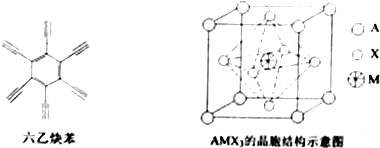
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
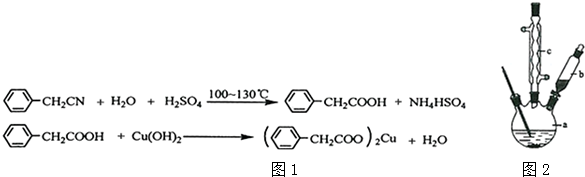
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com