
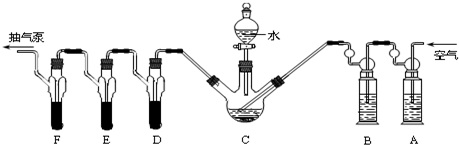
分析 (1)PH3具有较强的还原性,可用KMnO4和Na2SO3测定;
(2)磷化铝能与水或酸反应产生有毒气体膦(PH3),与水反应结合水的结构可知磷化铝能与水反应生成氢氧化铝和PH3;
(3)依据连续装置中的压强变化分析判断;
(4)高锰酸钾溶液是强氧化剂可以吸收还原性气体;碱性焦性没食子酸溶液,焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧;
(5)依据消耗的亚硫酸钠物质的量结合定量关系计算剩余高锰酸钾,计算吸收PH3需要的高锰酸钾物质的量,进一步计算PH3物质的量,得到PH3含量.
解答 解:(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,可用KMnO4和Na2SO3测定粮食中残留磷化物含量;安装蒸馏吸收装置,A、D、E、F各装1.00mL浓度为5.00×10-4mol/L的酸性KMnO4溶液,B中装碱性焦性没食子酸(1,2,3-三羟基苯),C中装200g原粮,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,然后用高锰酸钾滴定测定PH3,然后用Na2SO3标准溶液滴定剩余的KMnO4溶液,可得磷化物含量,故答案为:粮食中残留磷化物的定量测定;
(2)依据题干信息,磷化铝和水反应,水解生成PH3和氢氧化铝,反应的化学方程式为:AlP+3H2O=Al(OH)3↓+PH3↑,
故答案为:AlP+3H2O=Al(OH)3↓+PH3↑;
(3)利用连续装置特征,结合气体压强变化,可以利用抽气泵抽气观察各装置中气体的产生,若有气泡冒出,证明气密性完好;
故答案为:打开抽气泵抽气,观察各装置中是否有气泡产生;
(4)依据装置图中装置中的试剂选择分析判断,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,用滴定方法测定的PH3减小,结果偏低;
故答案为:还原性气体;除去空气中的O2;偏低;
(5)加水稀释至25mL,用浓度为2.5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应:2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O;2KMnO4~5Na2SO3;未反应的高锰酸钾物质的量=0.0110L×2.5×10-4mol/L×$\frac{2}{5}$=1.1×10-6mol;与PH3反应的高锰酸钾物质的量=1.00×10-3mol/L×0.0030L-1.1×10-6mol=2.0×10-6mol;根据反应 5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH3~8KMnO4;计算得到PH3物质的量=2.0×10-6mol×$\frac{5}{8}$=1.25×10-6mol,则PH3的质量分数=$\frac{1.25×10-6mol×34g/mo}{0.2kg}$=2.12×10-4g/kg,
故答案为:2.12×10-4.
点评 本题以粮食中残留磷化氢的定量测定为命题背景,考查元素化合物知识氧化还原反应滴定及相关计算,综合考查了水解方程式的书写、非常规装置气密性的检验方法、实验原理的理解和定量测定的有关计算和误差分析等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂的氢化是指将不饱和程度较高、熔点较低的液态油,通过催化加氢,可提高饱和度,转化成半固态的脂肪的过程 | |
| B. | 在酸性条件下,蔗糖水解成葡萄糖和果糖,它们都能被溴水氧化 | |
| C. | 氨基酸是两性化合物,只有两个不同氨基酸分子间脱水才能形成肽键 | |
| D. | 蛋白质遇到醋酸铅变性沉淀,加入大量的水,沉淀还可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
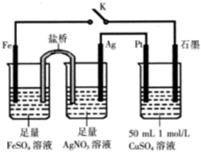
| A. | 盐桥中的电解质可以用KCl | |
| B. | 闭合K,外电路电流方向为Fe电极→石墨电极 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 导线中流过0.15 mol e-时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子;有种不同能级的电子。基态的F3+核外电子排布式是。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是。
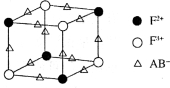
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的1/8(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2—NH2)形成配离子:
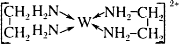
该配离子中含有的化学键类型有。(填字母)
a.配位键
B.极性键
C.离子键
D.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2—NH2)中C原子的杂化方式为。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示。下列判断正确的是
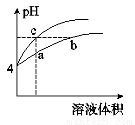
A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度:a>b>c
C.b点溶液中:c(H+)+c(NH3·H2O)=c(OH-)
D.用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体
积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 体积、pH均相同的醋酸和盐酸完会溶解等量的镁粉(少量),后者用时少 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| D. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
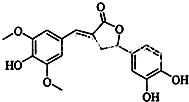
| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol 该化合物最多能与5mol NaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | Cl2既是氧化产物又是还原产物 | |
| D. | 0.1mol KClO3 参加反应时有1mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com