
| A. | 恒容容器内混合气体的密度不再变化 | |
| B. | AB3的生成速率与B2的生成速率之比为2:3 | |
| C. | 恒压容器内混合气体的总物质的量不再变化 | |
| D. | 单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变.
解答 解:A.反应前后气体总质量不变、容器体积不变,所以密度始终不变,不能用密度判断平衡状态,故A选;
B.AB3的生成速率与B2的生成速率之比为2:3,正逆反应速率相等,反应达到平衡状态,故B不选;
C.反应前后气体总物质的量减小,当物质的量不变时正逆反应速率相等,反应达到平衡状态,故C不选;
D.单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键,同时生成a mol A≡A键,正逆反应速率相等,反应达到平衡状态,故D不选;
故选A.
点评 本题考查化学平衡状态判断,只有反应前后改变的物理量才能作为平衡状态判断依据,侧重考查学生分析判断能力,题目难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题
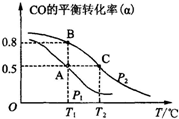 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
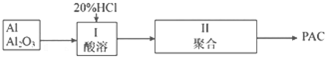
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
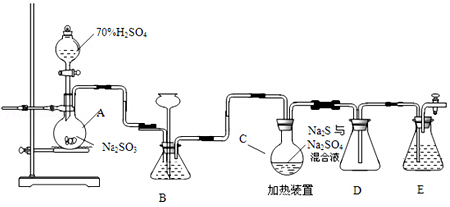
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L | |
| B. | 1 L该溶液中含有Na2CO3的质量为10.6 g | |
| C. | 从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L | |
| D. | 取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 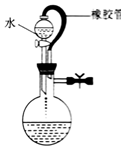 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 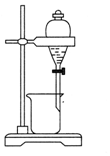 分离酒精和水 | D. | 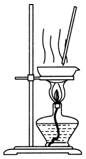 蒸干NH4Cl溶液制NH4Cl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com