
【题目】在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g) ![]() cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是

A. 该温度下此反应的平衡常数的值K=25/4
B. 平衡时,M的转化率为50℅,若条件改为恒温恒压,则达平衡时M的转化率小于50℅
C. 若开始时向容器中充入2molM和1molN,达到平衡时,M的体积分数小于50℅
D. 在5min时,再向体系中充入少量He,重新达到平衡前v(正)>V(逆)
【答案】C
【解析】
试题△n(M)=0.8mol-0.4mol=0.4mol,△n(N)=0.4mol-0.2mol=0.2mol,△n(Q)=0.2mol,所以a:b:c=2:1:1,化学方程式为2M(g)+N(g)![]() Q(g),A.平衡时,c(M)=0.4mol÷2L=0.2mol/L,c(N)=c(Q)=0.2mol÷2L=0.1mol/L,K=
Q(g),A.平衡时,c(M)=0.4mol÷2L=0.2mol/L,c(N)=c(Q)=0.2mol÷2L=0.1mol/L,K=![]() =
=![]() =25,故A错误;B.平衡时,M的转化率为50%,若条件改为恒温恒压,由于正方应是体积减小的可逆反应,因此保存恒温恒压有利于平衡向正反应方向进行,则达平衡时M的转化率大于50%,故B错误;C.在该条件下,M的体积分数为:
=25,故A错误;B.平衡时,M的转化率为50%,若条件改为恒温恒压,由于正方应是体积减小的可逆反应,因此保存恒温恒压有利于平衡向正反应方向进行,则达平衡时M的转化率大于50%,故B错误;C.在该条件下,M的体积分数为:![]() ×100%=50%。由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误,答案选C。
×100%=50%。由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误,答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
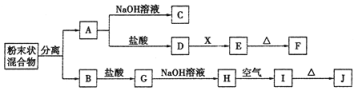
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
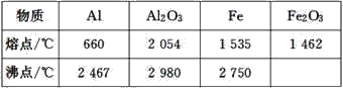
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__,反应的离子方程式为_。
(3)实验室溶解该熔融物,下列试剂中最好的是__(填序号),并说明理由:__。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度均为0.1mol·L-1的Na0H 溶液和盐酸分别滴定体积均为20mL、浓度均为0.1mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
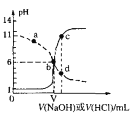
A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+)>c(Cl-)>c(OH-)>c(BOH)
C. b点时两种协液中水的电离程度相同.且V=20
D. c、d两点溶液混合后微粒之间存在关系:c(H+)= c(OH-)+c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是( )

A.X是N2
B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的
C.NH4+中含有非极性共价键
D.上述历程的总反应为:2NH3+NO +NO2 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国中草药文化源远流长,通过临床试验,从某中草药中提取的有机物具有较好的治疗癌症的作用,该有机物的结构如图所示。下列说法中错误的是( )
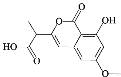
A.分子式为C13H12O6
B.该有机物能发生取代反应、加成反应、氧化反应
C.1mol该有机物与NaOH反应最多消耗2molNaOH
D.1mol该有机物与溴水反应最多消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
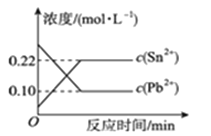
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。酒精喷灯可用作高温热源。正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。请回答下列问题:

(1)连接装置导管口的顺序:混合气体→__________________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是__________________________________;
证明CO存在的有关反应的化学方程式是__________________________________________。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?________(填“有”或“没有”),并简述理由:
_________________________________________________________________。
(4)本实验尾气处理的方法是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯可作化工原料和清洁能源,研究其制备和综合利用具有重要意义,请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) ΔH制备乙烯。
C2H4(g)+H2(g) ΔH制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
则ΔH=______kJ·mol-1。
(2)乙烯可制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
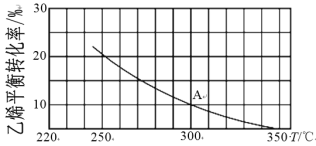
①该反应为______热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____mol,计算A点对应温度下的平衡常数K=_____(用含a的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
a.k正增大,k逆减小 b.k正减小,k逆增大c.k正增大的倍数大于k逆 d.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率_____10%(填“>”、“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com