
 ,据此回答;
,据此回答; ,可发生加聚反应,方程式为
,可发生加聚反应,方程式为 ,
, ;
; 、
、 、
、 、
、 等4种,
等4种, 或
或 或
或  或
或 .
.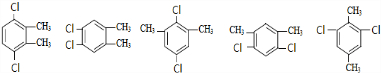 ,故符合条件的同分异构体共有6种,故答案为:6;
,故符合条件的同分异构体共有6种,故答案为:6;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、加入稀硫酸后加热使之水解,检验水解产物能否发生银镜反应 |
| B、浸入浓硝酸中,观察其颜色是否变黄色 |
| C、在火中灼烧,闻其是否有烧焦羽毛的气味 |
| D、通过化学方法测其组成中是否含有硫、氮等元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性A->B- |
| B、还原性A->B- |
| C、氧化性A>B |
| D、还原性A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.0 g醋酸晶体中含有H+的数目为0.1 NA |
| B、标准状况下,11.2 L CO2中含氧原子的数目等于NA |
| C、64 g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2 NA |
| D、1 mol Cl-含有的核外电子总数为8 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Na<Mg<Al |
| B、热稳定性:HCl>H2S>PH3 |
| C、酸性强弱:H2SiO4<H2CO3<H3PO4 |
| D、还原性:K>Na>Li |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一次反应停止时,剩余B 9 g |
| B、第一次反应停止时,剩余C 6 g |
| C、反应中A和C的质量比是5:3 |
| D、第二次反应后,C剩余5 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com