
��0.2 mol��L-1��KI��Һ��0.05 mol��L-1 Fe2(SO4)3��Һ�������Ϻ�ȡ���Һ�ֱ��������ʵ�飬��˵����Һ�д��ڻ�ѧƽ�⡰2Fe3++2I��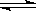 2Fe2++I2������
2Fe2++I2������
ʵ���� | ʵ����� | ʵ������ |
�� | ����KSCN��Һ | ��Һ���ɫ |
�� | ����AgNO3��Һ | �л�ɫ�������� |
�� | ����K3[Fe(CN)6]��Һ | ����ɫ�������� |
�� | ���������Һ | ��Һ����ɫ |
A���ٺ͢� B���ں͢� C���ۺ͢� D���ٺ͢�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���������ʵĻ�ѧ������д��ȷ����( )
A����ϩ�Ľṹ��ʽΪCH2CH2
B���ǻ��ĵ���ʽ��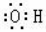
C��Ca2+�Ľṹʾ��ͼΪ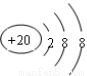
D���Ҵ��ķ���ʽ��CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ������ѧ�ڵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
���������й㷺����;�������к�����������Fe��Zn��Cu��Pt�� ���õ�ⷨ�Ʊ��ߴ��ȵ���(��֪��������Fe2����Ni2����Cu2��)������������ȷ����( )
���õ�ⷨ�Ʊ��ߴ��ȵ���(��֪��������Fe2����Ni2����Cu2��)������������ȷ����( )
A������������ԭ��Ӧ����缫��Ӧʽ��Ni2����2e��=Ni
B���������У����������ļ����������������������
C��������Һ�д��ڵ�������ֻ��Fe2����Zn2��
D�������۵ײ�����������ֻ��Cu��Pt
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
��ͼװ��(��)Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K��ͨ�����õ�طŵ�ʱ�Ļ�ѧ����ʽΪ��2K2S2 +KI3 = K2S4 +3KI��װ��(��)Ϊ��⺬��0.5mol NaCl����Һʾ��ͼ�����պϿ���Kʱ���缫X������Һ�ȱ�졣��պ�Kʱ������˵����ȷ����
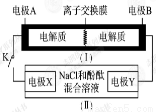
A��K�����ҵ���ͨ�����ӽ���Ĥ
B���缫A�Ϸ����ķ�ӦΪ��3I����2e-= I3��
C���缫X�Ϸ����ķ�ӦΪ��2Cl����2e-= Cl2��
D������0.1 mol K��ͨ�����ӽ���Ĥ��X�缫�ϲ���1.12 L(��״��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ѧ����ʽ��������ʵ�������ȷ����
A����0.1 mol/L��pH��1��NaHA��Һ�м���NaOH��Һ��H����OH�� = H2O
B���Խ�����Ϊ������ⱥ��NaCl��Һ��2Cl����2H2O H2����Cl2����2OH��
H2����Cl2����2OH��
C������������KIO3��Һ��KI��Һ������Ӧ����I2��IO3����5I����3H2O��3I2��6OH��
D��NH4Al(SO4)2��Һ�м���Ba(OH)2��ҺʹSO42����ȫ������
Al3+��2SO42����2Ba2+��4OH��= AlO2����2BaSO4����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
ijģ�⡰�˹���Ҷ���绯ѧʵ��װ������ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ��(C3H8O)������˵����ȷ����
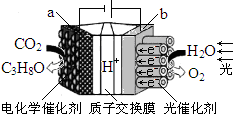
A����װ�ý���ѧ��ת��Ϊ���ܺ͵���
B����װ�ù���ʱ��H+��b������a����Ǩ��
C��ÿ����1mol O2����44gCO2����ԭ
D��a�缫�ķ�ӦΪ��3CO2+18H+��18e��=C3H8O+5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
��ѧ��һ��ʵ���Ե�ѧ�ƣ�����������ȷ����
A��������Դ������ͺͿ�������Ҫ��ѧ�ɷ���ͬ
B��������顱��Ч�ɷ�Ϊ���ᣬ��Ư�ۻ��ʹ��Ч������
C�����ú������ˮ�ܲ���������������֡�����ˮ���ǽ���
D�����ȷ�Ӧ�пɵõ�������ҵ�Ͽ������ø÷�Ӧ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
����˵������ȷ����( )
A�������������ʵ���Ȼ��֬���ڴ�����
B����֬�����Ի���������¶����ڴ�ˮ����ˮ��
C����֬���������ֱ��ͳ̶�Խ���۵�Խ��
D��������֬ˮ���IJ����ж��и���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ������ѧ��10�½β⻯ѧ���������棩 ���ͣ������
���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������(SO2)�ŷ������� 8%����������(NOx)�ŷ������� 10%��Ŀǰ������������Ⱦ�ж��ַ�����
��1���� CH4 ����ԭ��������������������������Ⱦ��
��֪����CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g)��H =��574 kJ/mol
��CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g)��H =��1160 kJ/mol
��H2O(g) = H2O(l) ��H =��44.0 kJ/mol
д�� CH4(g)�� NO2(g)��Ӧ���� N2(g)��CO2(g)�� H2O(l)���Ȼ�ѧ����ʽ��__________��
��2������ Fe2+��Fe3+�Ĵ����ã������¿ɽ� SO2 ת��Ϊ SO42-���Ӷ�ʵ�ֶ� SO2 ����������֪�� SO2 �ķ���ͨ�뺬 Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O������һ��Ӧ�� ���ӷ���ʽΪ__________��
��3���û���̿��ԭ��������������йط�ӦΪ C(s) + 2NO(g)  N2(g) + CO2(g)��ij�о�С�����ܱյ���� ������(��������������䣬��������������Բ���)���� NO �������Ļ���̿���ں���(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g) + CO2(g)��ij�о�С�����ܱյ���� ������(��������������䣬��������������Բ���)���� NO �������Ļ���̿���ں���(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��(mol/L) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
��10��20 min �Ԧ�(N2)��ʾ�ķ�Ӧ����Ϊ__________��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽ K=________�����ݱ������ݣ����� T1 ��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________(������λС��)��
��һ���¶��£����� NO ����ʼŨ�������� NO ��ƽ��ת����__________ (����������䡱��С��)��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ�����__________ (�����)��
A�����������ܶȱ��ֲ���
B������(NO) = 2����(CO2)
C��������ѹǿ���ֲ���
D�������� N2 ������������ֲ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com