
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液:K+、Fe2+、SO42-、NO3- |
分析 A.pH=1的溶液,显酸性,离子之间结合生成沉淀;
B.能使酚酞试液变红的溶液,溶液显碱性;
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液,显酸性;
D.水电离产生的c(OH-)=10-12 mol•L-1的溶液,为酸或碱溶液.
解答 解:A.pH=1的溶液,显酸性,Ag+分别与Cl-、SO42-结合生成沉淀,不能大量共存,故A错误;
B.能使酚酞试液变红的溶液,溶液显碱性,碱溶液中不能大量存在HCO3-,故B错误;
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液,显酸性,该组离子之间不反应,可大量共存,故C正确;
D.水电离产生的c(OH-)=10-12 mol•L-1的溶液,为酸或碱溶液,碱溶液中不能大量存在Fe2+,酸溶液中Fe2+、NO3-发生氧化还原反应,不能共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
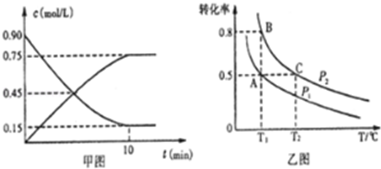
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
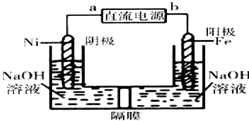 运用化学原理知识研究化学对于人类的生产生活、科研意义重大.
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Pt(Ⅱ)为阳极 | B. | 阳极区酸性增强 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Al→Al2O3→Al(OH)3→NaAl(OH)4 | ||
| C. | N2→NH3→NO→NO2→HNO3→NO2 | D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+H2SO4(浓) | B. | Cu+HNO3(浓) | C. | Fe+H2SO4(浓) | D. | C+H2SO4(浓) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com