
 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.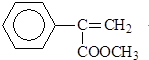 .
.
 .
.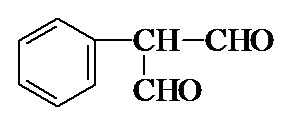 .
.分析 (1)根据的结构简式可知其分子式;
(2)含有碳碳双键,决定具有烯的性质;含有酯基决定具有酯的性质.苯环虽不是官能团,但含有苯环,具有苯的一些性质;
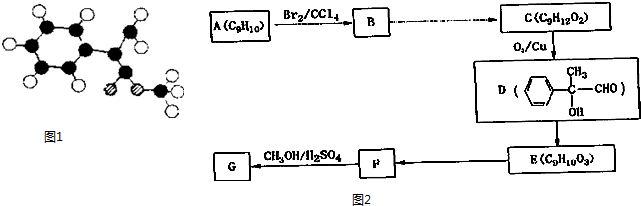
(3)G为肉桂酸甲酯的一种同分异构体,根据结构可知,黑色球是C原子、白色球是H原子、斜线球是O原子,再根据C的四价结构确定C原子间的成键情况,写出G的结构简式;
(4)由A到D的转化可知,A含有1个苯环、1个侧链,且侧链中含有1个碳碳双键,故A为 ,可知B为
,可知B为 ,C为
,C为 ,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构
,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构 ,所以D中的醛基被氧化为羧基而生成E
,所以D中的醛基被氧化为羧基而生成E ,根据G的结构可知,F为
,根据G的结构可知,F为 ,F与甲醇通过酯化反应反应的G,据此解答.
,F与甲醇通过酯化反应反应的G,据此解答.
解答 解:(1)根据的结构简式可知其分子式为C10H10O2,
故答案为:C10H10O2;
(2)A、分子中含有碳碳双键,能与溴的四氯化碳溶液发生加成反应,故A正确;
B、分子中含有碳碳双键,能被酸性高锰酸钾溶液氧化,而使酸性高锰酸钾溶液褪色,故B错误;
C、分子中含有酯基,在碱性条件下能发生水解反应,得到相应羧酸的盐和甲醇,故C正确;
D、分子中含有碳碳双键,能发生加聚反应,故D错误;
故答案为:AC;
(3)G为肉桂酸甲酯 的一种同分异构体,结合图中结构可知,黑色球是C原子、白色球是H原子、斜线球是O原子,再根据C的四价结构确定C原子间的成键情况,所以G的结构简式为
的一种同分异构体,结合图中结构可知,黑色球是C原子、白色球是H原子、斜线球是O原子,再根据C的四价结构确定C原子间的成键情况,所以G的结构简式为 ,
,
故答案为: ;
;
(4)由A到D的转化可知,A含有1个苯环、1个侧链,且侧链中含有1个碳碳双键,故A为 ,可知B为
,可知B为 ,C为
,C为 ,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构
,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构 ,所以D中的醛基被氧化为羧基而生成E为
,所以D中的醛基被氧化为羧基而生成E为 ,根据G的结构可知,F为
,根据G的结构可知,F为 ,F与甲醇通过酯化反应反应的G,
,F与甲醇通过酯化反应反应的G,
①E为 ,化合物E中的官能团有羧基、羟基,
,化合物E中的官能团有羧基、羟基,
故答案为:羧基、羟基;
②B碱性水解得C,所以B→C的反应条件是 NaOH水溶液,加热,E→F的反应类型是 消去反应,F→G该反应的化学方程式为  ,
,
故答案为:NaOH水溶液,加热;消去反应; ;
;
③F为 ,根据条件Ⅰ.分子内含苯环,且苯环上只有一个支链;Ⅱ.一定条件下,1mol该物体与足量银氨溶液充分反映,生成4mol银单质,说明有两个醛基,则符合条件的F的同分异构体的结构简式为
,根据条件Ⅰ.分子内含苯环,且苯环上只有一个支链;Ⅱ.一定条件下,1mol该物体与足量银氨溶液充分反映,生成4mol银单质,说明有两个醛基,则符合条件的F的同分异构体的结构简式为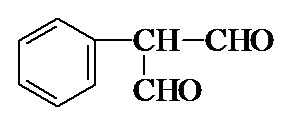
故答案为: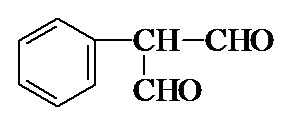
点评 题以肉桂酸甲酯为载体考查官能团性质、同分异构体、有机合成、有机物推断等,难度中等,旨在考查学生对知识的掌握与迁移运用、思维分析等能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下CH4是液体 | B. | 一氯甲烷分子式为CH4Cl | ||
| C. | CH4与Cl2可以发生加成反应 | D. | CH4完全燃烧生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
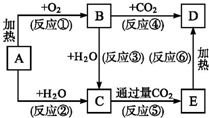 框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | O得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
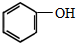 (制酚醛树脂)
(制酚醛树脂) 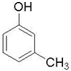 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
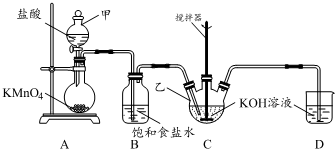 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com