
| A. | 1:1 | B. | 1:2 | C. | 2:11 | D. | 4:1 |
分析 起酸性作用的硝酸生成硝酸铜,据此计算参加反应Cu失去电子物质的量,被还原的硝酸生成NO和NO2,根据氮原子守恒与电子转移守恒计算NO和NO2的物质的量,相同条件下气体体积之比等于其物质的量之比.
解答 解:参加反应的30g HNO3中被还原的HNO3质量为13g,
被还原的硝酸为$\frac{13g}{63g/mol}$=$\frac{13}{63}$mol,
则其酸性作用的硝酸为30g-13g=17g,其物质的量为$\frac{17g}{63g/mol}$=$\frac{17}{63}$mol,由电荷守恒可知,Cu失去电子为$\frac{17}{63}$mol,
设NO和NO2的物质的量分别为xmol、ymol,
由电子转移守恒有:3x+y=$\frac{17}{63}$,
由N原子守恒有:x+y=$\frac{13}{63}$,
联立方程解得:x=$\frac{2}{63}$,y=$\frac{11}{63}$,
相同条件下气体体积之比等于其物质的量之比,故NO和NO2的体积之比为$\frac{2}{63}$mol:$\frac{11}{63}$mol=2:11,
故选C.
点评 本题考查混合物计算、氧化还原反应计算,注意利用电子转移守恒与原子守恒解答,侧重考查学生分析计算能力,难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸 | |
| B. | SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同 | |
| C. | 可用CuSO4溶液除去制乙炔时混有的杂质H2S | |
| D. | 在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
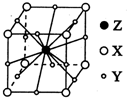 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L苯含有的分子数为0.1nA | |
| B. | 25℃时,PH=13的Ba(OH)2的溶液中含有OH-的数目为0.2nA | |
| C. | 1L0.1mol•L-1Al2(SO4 )3的溶液Al3+的数目为0.2nA | |
| D. | 1.5molNO2与足量H2O反应,转移的电子数为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
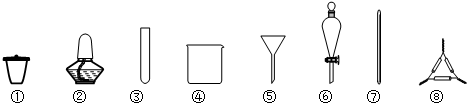
| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物都是强电解质 | |
| B. | 一种金属元素只能有一种氧化物 | |
| C. | 在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 | |
| D. | 能与金属铝反应产生氢气的溶液一定是酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com