
 如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
(2)根据实验具体操作步骤有:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,据此排序,选择实验所需仪器;
(3)稀释浓硫酸用玻璃棒搅拌,移液时用玻璃棒引流;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)密度为1.84g/mL,质量分数为98%的浓硫酸,物质的量浓度C=$\frac{1000×98%×1.84}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变计算得:18.4mol/L×V=1mol•L-1×500mL,解得V=27.2mL;
故答案为:27.2;
(2)用浓硫酸配制稀硫酸的一般操作步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的操作步骤为:②①③⑧⑤⑥⑦④,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、500mL容量瓶,
故答案为:②①③⑧⑤⑥⑦④,①②④⑥⑦⑧;
(3)稀释浓硫酸用玻璃棒搅拌,移液时用玻璃棒引流;
故答案为:搅拌,引流;
(4)A.洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,溶质物质的量偏大,溶液浓度偏高,故A选;
B.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故B选;
C.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故E选;
F.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故F不选;
故选:ABE.
点评 本题考查了配制一定物质的量浓度的溶液的方法判断,题目难度不大,要求学生熟练掌握配制一定物质的量浓度的溶液的步骤及正确操作方法.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、MnO4-、SO42-、CO32- | |
| B. | 在含大量 Ba2+的溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在 pH=1 的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | B. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | ||
| C. | NaCl+AgNO3═NaNO3+AgCl↓ | D. | Zn+CuSO4═Cu+ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品. +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:实验题
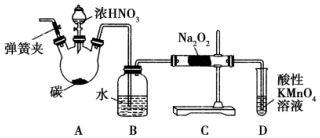 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
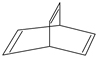 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
.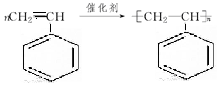 .
.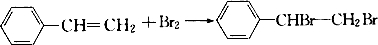 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L的稀盐酸1L | B. | 73gHCl | ||
| C. | 44.8LHCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com