
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3 的混合液,经测定ClO-与ClO![]() 的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A. 21∶5 B. 11∶3 C. 3∶1 D. 4∶1
【答案】D
【解析】试题分析:Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO-与ClO3-的物质的量浓度之比为1:3,则可设ClO-为1mol,ClO3-为3mol,被氧化的Cl共为4mol,失去电子的总物质的量为1mol×(1-0)+3mol×(5-0)=16mol,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成NaCl是被还原的过程,化合价由0价降低为-1价,则得到电子的物质的量也应为16mol,则被还原的Cl的物质的量为16mol,所以被还原的氯元素和被氧化的氯元素的物质的量之比为16mol:4mol=4:1,但选D。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
B. Al2O3熔点高,可用于制作耐高温仪器
C. 明矾能水解生成Al(OH)3胶体,可用作净水剂
D. SiO2有导电性,可用于制备光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【百强校·2016届山西大学附中12月月考】已知热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 ( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015安徽卷】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
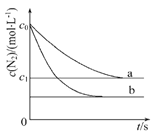
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)![]() 2c(g);△H1<0
2c(g);△H1<0
x(g)+3y(g)![]() 2z(g);△H2>0
2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH为3的FeCl3溶液、pH为11的Na2CO3溶液和pH为3的盐酸中,由水电离出来的H+的浓度分别为c1、c2、c3,它们之间的关系是
A.c1<c2<c3 B.c1=c2>c3 C.c1>c2>c3 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A. 0.5 molAl与足量盐酸反应转移电子数为1NA
B. 标准状况下,11.2L SO3所含的分子数为0.5NA
C. 0.1molCH4所含的电子数为1NA
D. 46gNO2和N2O4的混合物含有的分子数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯消毒剂是国际上公认的含氯消毒剂中唯一的高效消毒灭菌剂,实验室中KClO3和浓盐酸在一定温度下反应会生成二氧化氯,其变化可表述为:
2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________。
(2)氧化剂与还原剂的物质的量之比是________________。
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm—3,为使用方便,请计算出该浓盐酸中HCI的物质的量浓度________________mol·L—l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com