

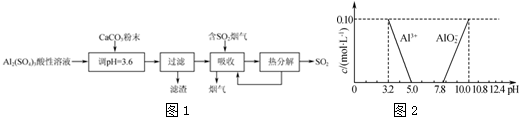
分析 (1)①各组分浓度不变,反应达到平衡状态;
②根据反应速率v=$\frac{△c}{△t}$计算;
③30min时,CO2浓度减小,其他物质浓度不变,改变的条件是减小CO2的浓度;根据平衡常数K=$\frac{{c}^{2}(C{O}_{2})•c({S}_{2})}{{c}^{2}(S{O}_{2})}$计算;
(2)①Na2SO3溶液吸收SO2生成NaHSO3;
②常温下,当吸收至pH=6时,溶液呈酸性;
(3)Pt(1)电极进入SO2,硫酸浓度增大,SO2可知失电子,作负极;每molNO2得电子4mol.
解答 解:(1)①从图中可看出20min时各组分浓度不变,此时反应达到平衡,故答案为:20;
②0~20min时,SO2浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则反应速率表示为V(SO2)=$\frac{0.6mol/L}{20min}$=0.03mol/(L•min),故答案为:0.03mol/(L•min);
③30min时,CO2浓度减小,其他物质浓度不变,改变的条件是减小CO2的浓度,40min时的平衡常数和20min时相同,20min时,SO2(g)=0.4mol/L,S2(g)=0.3mol/L,CO2(g)=0.6mol/L,则平衡常数K=$\frac{0.3×0.{6}^{2}}{0.{4}^{2}}$=0.675,故答案为:减小CO2的浓度;0.675;
(2)①Na2SO3溶液吸收SO2的离子方程式为SO32-+SO2+H2O=2HSO3-,故答案为:SO32-+SO2+H2O=2HSO3-;
②常温下,当吸收至pH=6时,
a.根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正确;
b.根据物料守恒,当溶质完全为NaHSO3时,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),若还存在Na2SO3,则c(Na+)>c(SO32-)+c(HSO3-)+c(H2SO3),故b错误;
c.pH=6,c(OH-)<c(H+),故c错误;
d.HSO3-电离程度大于水解程度,pH=6,水电离出c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-6}}$=l×l0-8 mol/L,故d正确;
故答案为:ad;
(3)SO2在Pt(1)电极失电子生成SO42-,电极反应式为SO2+2H2O-2e-=SO42-+4H+,NO2中N的化合价为+4价,转化为0价的N2,每molNO2得电子4mol,若阳极转移电子6mol,则理论上处理NO2气体为$\frac{6}{4}$=1.5mol.
故答案为:SO2+2H2O-2e-=SO42-+4H+;1.5.
点评 本题考查反应速率计算、化学平衡计算与影响因素、离子浓度比较、电极反应式书写、电解池有关计算等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
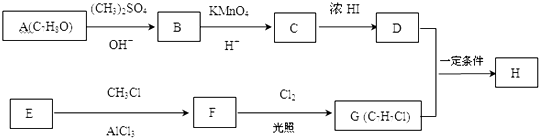
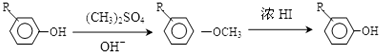
 ,由C生成D的化学方程式为
,由C生成D的化学方程式为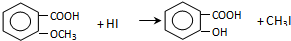 .
.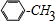 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$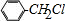 +HCl.反应类型为取代反应
+HCl.反应类型为取代反应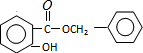 .
. (或
(或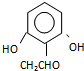 ).
).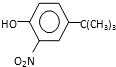 ,反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
,反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为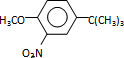 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.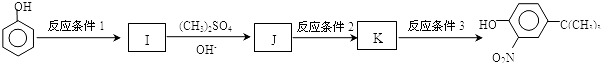
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
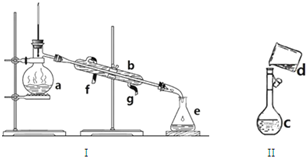
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性比强酸弱 | |
| B. | 10 mL 1 mol/L的HA溶液与10 mL 1 mol/L的NaOH溶液恰好完全反应 | |
| C. | NaA溶液的pH>7 | |
| D. | 0.1 mol/L HA溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
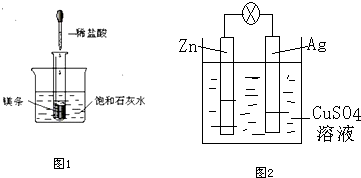
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-→ClO-+Cl-+H2O | |
| B. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-→Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:H++ClO-→HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
带玻璃塞的试剂瓶 | 聚乙烯盒 | 铁罐车 | 铝制饭盒 |
| 可用于盛放氢氧化钠溶液 | 可用于盛装食品 | 可用于运输浓硫酸 | 不宜长时间存放酸性或碱性的食物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com