
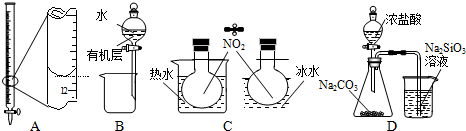
| A. | 装置A记录滴定终点读数为12.20 mL | |
| B. | 装置B可用于提取I2的CCl4溶液中的I2 | |
| C. | 装置C可用于探究温度对2NO2?N2O4平衡体系的影响 | |
| D. | 装置D可用于比较HCl、H2CO3和H2SiO3的酸性强弱 |
分析 A.滴定管的刻度从上到下依次增大;
B.应用蒸馏的方法提取I2的CCl4溶液中的I2;
C.2NO2?N2O4为放热反应,温度不同,气体颜色不同;
D.盐酸易挥发,不能排除盐酸的影响.
解答 解:A.滴定管的刻度从上到下依次增大,正确读数应为11.80 mL,故A错误;
B.碘易溶于四氯化碳,应用蒸馏的方法提取I2的CCl4溶液中的I2,故B错误
C.2NO2?N2O4为放热反应,温度不同,气体颜色不同,则装置C可用于探究温度对2NO2?N2O4平衡体系的影响,故C正确;
D.盐酸易挥发,二氧化碳中混有HCl,不能比较碳酸与硅酸的酸性强弱,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、检验等基本实验操作的考查,为高考常见题型,侧重于实验方案的评价,注意把握物质的性质以及操作要点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| B. | 向1L 1mol/L 的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c (K+)+c (H+)=6c (ClO3-)+2c (ClO-)+c (HClO)+c (OH-) | |
| C. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$ CH2=CH2↑+Br-+H2O | |
| D. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
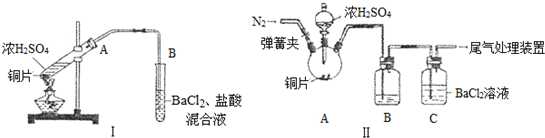
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
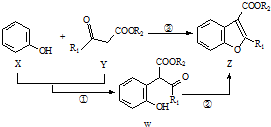 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )| A. | 反应①属于加成反应 | |
| B. | W能发生加成、水解、氧化反应 | |
| C. | X在一定条件下可发生缩聚反应 | |
| D. | 一定条件下Z与足量H2反应后所得产物中至少含有4个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两种元素形成的化合物中原子个数比一定为2:1 | |
| B. | Z、Y两种元素形成的化合物中只能含有离子键 | |
| C. | W元素形成的单质熔点很高,是一种优良的耐火材料 | |
| D. | Z、W、Q三种元素的最高价氧化物对应的水化物能两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
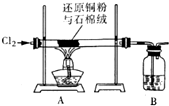 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.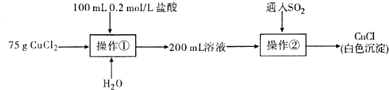
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
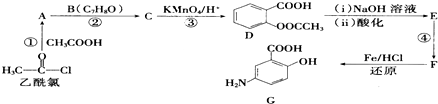
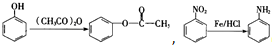 ,(具有还原性,极易被氧化)
,(具有还原性,极易被氧化) .
. .
.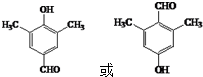 (写出其中一种结构简式).
(写出其中一种结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com