
| A. | 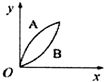 | B. | 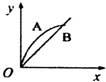 | C. | 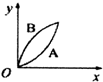 | D. | 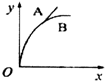 |
分析 增大固体的接触面积可以加快化学反应速率,根据盐酸和碳酸钙的反应情况来确定消耗的碳酸钙的量的多少,以此来解答.
解答 解:发生CaCO3+2HCl=CaCl2+H2O+CO2↑,A中n(CaCO3)=0.1mol,B中n(CaCO3)=0.05mol,n(HCl)=0.05L×1mol/L=0.01mol,由方程式可知A中盐酸不足,B中恰好完全反应,则生成的二氧化碳的体积相同,因碳酸钙粉末与盐酸的反应速率比碳酸钙固体的反应速率要快,则只有C正确.
故选C.
点评 本题考查外界条件对反应速率的影响,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意影响化学反应速率的因素以及物质发生变化的实质.


科目:高中化学 来源: 题型:实验题
 .一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键
.一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键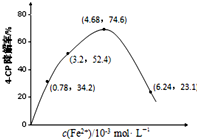
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑦ | C. | ①②⑥ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
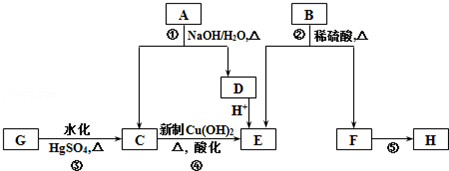
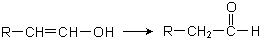
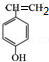
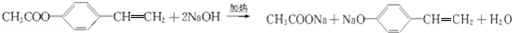 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可以在空气中燃烧 | |
| B. | 与C12发生取代反应 | |
| C. | 可以与溴水中的溴反应而使溴水褪色 | |
| D. | 能使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g的NH4+离子中含有的电子数为0.1NA | |
| B. | 1mol Na2O2 固体中含离子总数为4NA | |
| C. | 标准状况下,2.24L CCl4所含的共价键数为O.4NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO${\;}_{3}^{-}$、Cl- | B. | Fe3+、SCN-、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Mg2+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com