
【题目】已知a、b、c、d四种元素均为短周期主族元素,原子序数依次递增,c元素的单质或含c元素的化合物,焰色反应显黄色,a、b两原子可形成常温下呈液态的的X、Y两种化合物,其中X中a与b原子个数之比为2:1,Y中a与b原子个数之比为1:1,若用a、b、c、d表示它们的单质,单质之间有如下反应:

化合物之间反应:甲+Z→X + d;甲+Y →M。
M常温下是油状液体,它的浓溶液在常温下可用铁或铝制器运输保存。它的浓溶液和另一种酸的浓溶液常用来制炸药,M也用来制磷酸,M还可用于制铅蓄电池。
(1)写出C的元素符号: _________ ,Y的电子式:_______________;
(2)在30%的Y的水溶液中加入MnO2,有大量b的单质气体放出,若在Y、MnO2的混合液中加入稀H2SO4,MnO2被还原成Mn2+ ,仍然产生大量b的单质气体,写出其离子方程式___________________________;
(3)向盛有NaOH和Y的混合液的烧杯中缓缓导入Cl2,产生火光和爆炸声,其中NaOH的作用是_________,对应离子方程式 ____________________________;
(4)由b、c、d三种元素可形成中学化学常见的三种盐丙、丁、戊,其相对分子质量依次增大。戊+M→丁+甲↑+d↓+X,在戊的水溶液中导入甲气体也有d单质的淡黄色沉淀。写出戊和M在水溶液中化学方程式___;
(5)由和M具有相同元素组成的化合物A的分子式为a2d2b8.工业上电解50%的M的水溶液可制得A,发生的反应为:2M![]() A+a2↑,写出阳极电极反应方程式:__________;将A溶液进行稀释又可制得Y。
A+a2↑,写出阳极电极反应方程式:__________;将A溶液进行稀释又可制得Y。
(6)利用c、d两单质之间的反应,可设计一种原电池反应:2C+d![]() C2d,其中正极的电极反应式为:____。
C2d,其中正极的电极反应式为:____。
【答案】Na ![]() H2O2+MnO2+2H+=Mn2++O2↑+2H2O 中和生成的HCl,有利于反应正向进行 H2O2+Cl2+2OH-=2Cl-+ O2↑+2H2O Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 2SO42- - 2e-= S2O82- S+ 2e-=S2-
H2O2+MnO2+2H+=Mn2++O2↑+2H2O 中和生成的HCl,有利于反应正向进行 H2O2+Cl2+2OH-=2Cl-+ O2↑+2H2O Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 2SO42- - 2e-= S2O82- S+ 2e-=S2-
【解析】
c元素的单质或含c元素的化合物,焰色反应显黄色,则c为Na元素;a、b两原子可形成常温下呈液态的的X、Y两种化合物,其中X中a与b原子个数之比为2:1,Y中a与b原子个数之比为1:1,则a为H元素,b为O元素,X为H2O,Y为H2O2;M常温下是油状液体,它的浓溶液在常温下可用铁或铝制容器运输保存,则M为H2SO4,因为甲+Y →M,则甲为SO2,又因为b+d→甲,则d为S元素。Z为H2S,乙为Na2S。
(1)由上述分析可知,c的元素符号为:Na,Y的电子式:![]() 。本小题答案为:Na;
。本小题答案为:Na;![]() 。
。
(2)在30%的H2O2的水溶液中加入MnO2,有大量b的单质气体放出,若在H2O2、MnO2的混合液中加入稀H2SO4,MnO2被还原成Mn2+,仍然产生大量b的单质气体,则反应方程式为:H2O2+MnO2+H2SO4=MnSO4+O2↑+2H2O,离子方程式为:H2O2+MnO2+2H+=Mn2++O2↑+2H2O。本小题答案为:H2O2+MnO2+2H+=Mn2++O2↑+2H2O。
(3)向盛有NaOH和H2O2的混合液的烧杯中缓缓导入Cl2,产生火光和爆炸声,是NaOH、H2O2和Cl2反应生成了NaCl、O2和H2O,则离子方程式为:H2O2+Cl2+2OH-=2Cl-+ O2↑+2H2O , 反应中NaOH中和生成的HCl,有利于反应正向进行。本小题答案为;中和生成的HCl有利于反应正向进行;H2O2+Cl2+2OH-=2Cl-+ O2↑+2H2O。
(4)由O、Na、S三种元素可形成中学化学常见的三种盐丙、丁、戊,其相对分子质量依次增大。戊+M→丁+甲↑+d↓+X,在戊的水溶液中导入甲气体也有d单质的淡黄色沉淀。则丙、丁、戊分别为Na2SO3、Na2SO4、Na2S2O3。则戊和M在水溶液中化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O。本小题答案为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O。
(5)由和H2SO4具有相同元素组成的化合物A的分子式为a2d2b8,可推出A为H2S2O8。工业上电解50%的H2SO4 的水溶液可制得A,发生的反应为:2M![]() A+a2↑,则此反应为2H2SO4
A+a2↑,则此反应为2H2SO4![]() H2S2O8+H2↑,由于阳极失电子发生氧化反应,则阳极电极反应方程式:2SO42- - 2e-= S2O82-。本小题答案为:2SO42- - 2e-= S2O82-。
H2S2O8+H2↑,由于阳极失电子发生氧化反应,则阳极电极反应方程式:2SO42- - 2e-= S2O82-。本小题答案为:2SO42- - 2e-= S2O82-。
(6)因为正极得电子发生还原反应,则正极的电极反应式为:S+ 2e-=S2-。本小题答案为:S+ 2e-=S2-。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时, c mol·L—1CH3COOH 溶液加水稀释, 溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法不正确的是
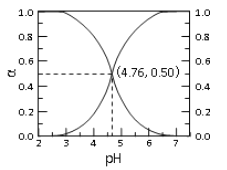
A. 由图可知, 25℃时醋酸的 Ka=10-4.76
B. c mol·L—1CH3COOH 溶液加水稀释中, α(CH3COOH)增大, c(CH3COOˉ)也一定增大
C. 在 pH=4.76 的溶液中通入 HCl, α(CH3COOH)增大,α(CH3COOˉ)减小, α(CH3COOH)+α(CH3COOˉ)=1
D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号B:________C:________
(2)BA2的电子式____________,BA2分子中化学键属于________键.。
(3)D2A2的化学式___________.
(4)C在元素周期表中的位置是第_______周期,______族,其原子结构示意图为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )

A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
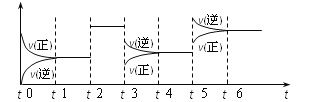
A. t5时增大了压强 B. t3时降低了温度
C. t2时加入了催化剂 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,在0.1mol·L﹣1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:(填“正向”、“逆向”或“不移动”, “增大”、“减小”或“不变”, 填“>”、“<”或“=”)
(1)向醋酸中加入醋酸钠固体,电离平衡向___________移动;pH __________
(2)向醋酸中加入碳酸钙固体,电离平衡向________移动;c(CH3COOH)_________.
(3)向醋酸中加入大量的水,c(OH-)_________.导电能力__________.
(4)体积相同、物质的量浓度均为0.1 mol·L-1的①盐酸、②醋酸两种溶液,pH:①_____②;与完全相同的镁条发生反应,开始时的反应速率:①______ ②;中和等量NaOH时消耗的体积:①______②;与足量的Zn反应生成H2的物质的量:①_______②。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是
A.2Na+2H20=2Na0H+H2↑ B.C12+H20=HC1+HC10
C.2F2+2H20=4HF+02 D.2H20![]() 2H2↑+02↑
2H2↑+02↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com