
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
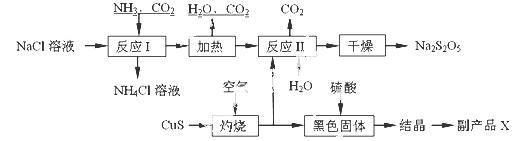
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:__________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
(1)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 (填字母)
a.加水时越过刻度线
b.未洗涤烧杯和玻璃棒
c.容量瓶内壁附有水珠而未干燥处理
d.定容时俯视刻度线
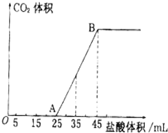
(2)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴中入1mol?L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入45mL盐酸溶液时,产生二氧化碳的物质的量为
②计算所取氢氧化钠溶液的体积V= mL
(3)取上述氢氧化钠溶液100mL,加入足量的铝,该反应的离子方程式为
反应生成的气体的物质的量为
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
其中正确的是( )
| 选项 | 气体 | a | b | c | d |
| A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3 溶液 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl 溶液 | 消石灰 | H2O | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.d点溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和
2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的
气体的体积为(设反应中HNO3被还原成NO) ( )
A.0.448L B.0.224L C.0.896L D.0.672L
查看答案和解析>>
科目:高中化学 来源: 题型:
相同物质的量的下列物质:①金属钠 ②烧碱 ③过氧化钠 ④氧化钠,长期放置在空气中(不考虑潮解和水解),最后质量都会增加,按增加的质量由大到小排列,正确的是( )
A. ①>②>④>③ B. ①>②>③>④ C. ④>①>③>② D. ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba (FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
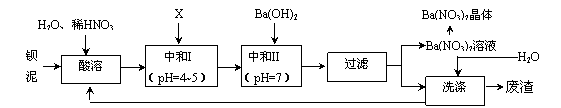
已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③kSP(BaSO4)=l.l×l 0-10,kSP (BaCO3)=5 .l×l0-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理_____________________________________________________________。
(2)上述流程中酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为_______________________________________________。
(3)该厂结合实际,图中X应选用_____________(填字母)。
A.BaCl2 B.BaCO3 C.Ba(NO3) 2 D.Ba(OH) 2
(4)中和I使溶液的pH为4~5的目的是________________________________;结合离子方程式简述其原理:________________________________。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是_____________________。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取wg晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m g,则该晶体的纯度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化物在自然界中的部分循环关系如下。
 |
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
S(s) + O2(g)  SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com