
| ||
| ||
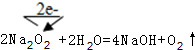 ,
,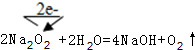 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:(1)甲处河水呈乳白色;(2)乙处河水呈浅蓝色浑浊;(3)丙处河水由浑变清;(4)丁处产生气泡,河水仍清.请推断:
在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:(1)甲处河水呈乳白色;(2)乙处河水呈浅蓝色浑浊;(3)丙处河水由浑变清;(4)丁处产生气泡,河水仍清.请推断:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一元素的单质,不可能既能与酸反应,又能与碱反应 |
| B、IA族元素的金属性一定比IIA族元素的金属性强 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com