
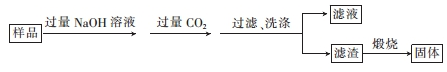
分析 (1)对于主族元素,周期数=电子层数,族序数=最外层电子数.据此判断该元素在周期表中位置;根据同主族元素原子序数越大,金属性越强,其对应的盐碱性越强;
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/L NH4A1(SO4)2溶液混合,即两者等物质的量混合,所以2mmol的硫酸钡和$\frac{4}{3}$mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和$\frac{2}{3}$mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性;
(3)①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒;
②煅烧得氧化铝,根据铝守恒分析得:2A1N~~A12O3,由关系式求氮化铝的质量,然后代入质量分数进行计算.
解答 解:(1)原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族;同主族元素原子序数越大,金属性越强,其对应的盐溶液碱性越强,镓、硼与铝位于同一主族,金属性镓>铝>硼,故碱性Na[Ga(OH)4]>Na[A1(OH)4]>Na[B(OH)4],故答案为:三;ⅢA;③>①>②;
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/L NH4A1(SO4)2溶液混合,即两者等物质的量混合,所以2mmol的硫酸钡和$\frac{4}{3}$mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和$\frac{2}{3}$mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性,所以离子浓度的大小为:c(SO42-)>c(NH4+ )>c(Al3+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(NH4+ )>c(Al3+)>c(H+)>c(OH-);
(3)①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒,故答案为:玻璃棒;
②煅烧得氧化铝,根据铝守恒分析得:2A1N~~A12O3,
2×(27+14)102
m(A1N) 5.1g
所以$\frac{2×(27+14)}{m(AlN)}=\frac{102}{5.1g}$,解之得:m(A1N)=4.1g,则样品中A1N的质量分数为 $\frac{4.1g}{4.2g}×100%$=97.62%,
答:样品中A1N的质量分数为97.62%.
点评 此题是盐水解程度和利用化学方程式计算相结合的题目以及离子浓度大小的,难度中等,该题步骤较多,应认真分析,另外要掌握关系法的应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅 | B. | 硫 | C. | 铝 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式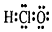 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+ | |
| B. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| C. | 加入过量氨水:Na+、NH4+、SO42-、AlO2- | |
| D. | 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅HCl | B. | 只有HCl和HClO | C. | 只有HCl和Cl2 | D. | HCl、HClO和Cl2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com