
| A. | 还原性 | B. | 氧化性 | C. | 脱水性 | D. | 吸水性 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电离方程式可写作H2O2?H++HO2-,HO2-?H++O22- | |
| B. | 加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大 | |
| C. | 加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动 | |
| D. | 加入少量氯化铁溶液,溶液中产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子质量 | B. | 质量 | C. | 密度 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
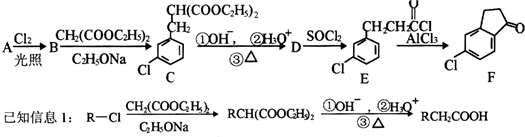
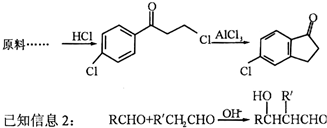
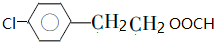 .
.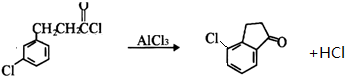 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 工业上用NO2与水反应制取NO:3NO2+H2O═NO3-+NO+2H+ | |
| C. | 用Cu除去CuCl2溶液中少量的FeCl3杂质:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 向NaAlO2溶液中通入过量CO2制A(OH)3:2AlO2-+CO2+3H2O═2A(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法判断固体中FeCl2是否存在 | |
| B. | ③中使高锰酸钾溶液褪色的是亚硝酸根离子 | |
| C. | B的pH<7 | |
| D. | 固体由Ba(OH)2、AlCl3、Na2SO3组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com