ŗĻ³É°±Éś²ś¼¼ŹõµÄ““Į¢æŖ±ŁĮĖČĖ¹¤¹ĢµŖµÄĶ¾¾¶£¬¶Ō»Æѧ¹¤Ņµ¼¼ŹõŅ²²śÉśĮĖÖŲ“óÓ°Ļģ£®ŗĻ³É°±·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗN
2£Øg£©+3H
2£Øg£©

2£Ø£Ø£ØNH
3£Øg£©”÷H=-92.2kJ/mol£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN
2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H
2æÉÓĆ¼×ĶéŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®
£Ø1£©ŌŚŅ»ČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷֊עČėN
2ŗĶH
2Į½ÖÖĘųĢ壬·¢ÉśÉĻŹö·“Ó¦£®ŌŚÄ³ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±ø÷ĪļÖŹµÄÅØ¶Č·Ö±šĪŖc£ØH
2£©=9.00mol/L£¬c£ØN
2£©=3.00mol/L£¬c£ØNH
3£©=4.00mol/L£¬“ĖĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ
7.32”Į10-3
7.32”Į10-3
£®
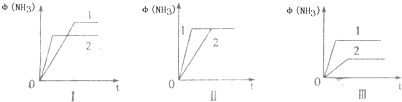
£Ø2£©ČżøöĻąĶ¬ČŻĘ÷ÖŠø÷³äČė1molN
2ŗĶ3molH
2£¬ŌŚ²»Ķ¬Ģõ¼žĻĀ·“Ó¦²¢“ļµ½Ę½ŗā£¬°±µÄĢå»ż·ÖŹżĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
D
D
£ØĢīŠņŗÅ£©£®
A£®Ķ¼IæÉÄÜŹĒ²»Ķ¬Ń¹Ēæ¶Ō·“Ó¦µÄÓ°Ļģ£¬ĒŅP
2£¾P
1B£®Ķ¼¢ņæÉÄÜŹĒ²»Ķ¬Ń¹Ēæ¶Ō·“Ó¦µÄÓ°Ļģ£¬ĒŅP
1£¾P
2C£®Ķ¼¢óæÉÄÜŹĒ²»Ķ¬ĪĀ¶Č¶Ō·“Ó¦µÄÓ°Ļģ£¬ĒŅT
1£¾T
2D£®Ķ¼¢ņŅ»¶ØŹĒŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ²»Ķ¬“߻ƼĮ¶Ō·“Ó¦µÄÓ°Ļģ£¬ĒŅ“߻ƼĮŠ§¹ū1£¾2
£Ø3£©½«Ė®ÕōĘųĶعżŗģČȵÄĢ漓²śÉśĖ®ÕōĘų£¬»Æѧ·½³ĢŹ½ĪŖ£ŗC£Øs£©+H
2O£Øg£©
H
2£Øg£©+CO£Øg£©”÷H=+131.3kJ£¬”÷S=+133.7J/KøĆ·“Ó¦ŌŚµĶĪĀĻĀÄÜ·ń×Ō·¢
·ń
·ń
£ØĢī£ŗÄÜ»ņ·ń£©£®
£Ø4£©¼×ĶéŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦·“Ó¦·½³ĢŹ½ĪŖ£ŗCH
4£Øg£©+H
2O£Øg£©=CO£Øg£©+3H
2£Øg£©£®²æ·ÖĪļÖŹµÄČ¼ÉÕČČŹż¾ŻČēĻĀ±ķ£ŗ
| Īļ ÖŹ |
Č¼ÉÕČČ£ØkJ?mol-1£© |
| H2£Øg£© |
-285.8 |
| CO£Øg£© |
-283.0 |
| CH4£Øg£© |
-890.3 |
ŅŃÖŖ1mol H
2O£Øg£©×Ŗ±äĪŖ1mol H
2O£Øl£©Ź±·Å³ö44.0kJČČĮ森Š“³öCH
4ŗĶH
2OŌŚøßĪĀĻĀ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½
CH4£Øg£©+H2O£Øg£©=CO£Øg£©+3H2£Øg£©”÷H=+206.1kJ?mol-1
CH4£Øg£©+H2O£Øg£©=CO£Øg£©+3H2£Øg£©”÷H=+206.1kJ?mol-1
£®
£Ø5£©ÓŠČĖÉčĻėŃ°ĒóŗĻŹŹµÄ“߻ƼĮŗĶµē¼«²ÄĮĻ£¬ŅŌN
2ӢH
2ĪŖµē¼«·“Ó¦Īļ£¬ŅŌHCl-NH
4ClĪŖµē½āÖŹČÜŅŗÖĘČ”ŠĀŠĶČ¼ĮĻµē³Ų£®ĒėŠ“³öøƵē³ŲµÄÕż¼«·“Ó¦Ź½
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
£®







 3NH3£Øg£©”÷H=-92.2kJ/mol£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H2æÉÓĆ¼×ĶéŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®ĪŅ¹śŗĻ³É°±¹¤ŅµÄæĒ°µÄÉś²śĢõ¼žĪŖ£ŗ“߻ƼĮ-Ģś“„Ć½£¬ĪĀ¶Č-400”«500”ę£¬Ń¹Ēæ-30”«50MPa£®
3NH3£Øg£©”÷H=-92.2kJ/mol£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H2æÉÓĆ¼×ĶéŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®ĪŅ¹śŗĻ³É°±¹¤ŅµÄæĒ°µÄÉś²śĢõ¼žĪŖ£ŗ“߻ƼĮ-Ģś“„Ć½£¬ĪĀ¶Č-400”«500”ę£¬Ń¹Ēæ-30”«50MPa£®
 2£Ø£Ø£ØNH3£Øg£©”÷H=-92.2kJ/mol£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H2æÉÓĆ¼×ĶéŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®
2£Ø£Ø£ØNH3£Øg£©”÷H=-92.2kJ/mol£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H2æÉÓĆ¼×ĶéŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®
 H2£Øg£©+CO£Øg£©”÷H=+131.3kJ£¬”÷S=+133.7J/KøĆ·“Ó¦ŌŚµĶĪĀĻĀÄÜ·ń×Ō·¢
H2£Øg£©+CO£Øg£©”÷H=+131.3kJ£¬”÷S=+133.7J/KøĆ·“Ó¦ŌŚµĶĪĀĻĀÄÜ·ń×Ō·¢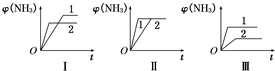 ŗĻ³É°±Éś²ś¼¼ŹõµÄ““Į¢æŖ±ŁĮĖČĖ¹¤¹ĢµŖµÄĶ¾¾¶£¬¶Ō»Æѧ¹¤Ņµ¼¼ŹõŅ²²śÉśĮĖÖŲ“óÓ°Ļģ£®ŗĻ³É°±·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-92.2kJ?mol-1£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H2æÉÓĆ¼×Ķé»ņ½¹ĢæÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®
ŗĻ³É°±Éś²ś¼¼ŹõµÄ““Į¢æŖ±ŁĮĖČĖ¹¤¹ĢµŖµÄĶ¾¾¶£¬¶Ō»Æѧ¹¤Ņµ¼¼ŹõŅ²²śÉśĮĖÖŲ“óÓ°Ļģ£®ŗĻ³É°±·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-92.2kJ?mol-1£®ŗĻ³É°±¹¤ŅµÖŠŌĮĻĘųN2æÉ“ÓæÕĘųÖŠ·ÖĄėµĆµ½£¬H2æÉÓĆ¼×Ķé»ņ½¹ĢæÓėĖ®ÕōĘų·“Ó¦ÖĘµĆ£®