
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等) 和黄铁矿粉(主要成分为FeS2) 制备铁黄的流程如下。
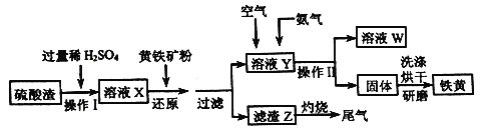
回答下列问题:
(1)操作I中为了提高硫酸渣的溶解速率,可采取的措施有_________(答两条即可)。
(2)溶液X中含有的金属离子有Fe3+和_____;溶液X中加入黄铁矿粉后,先发生反应FeS2+H2SO4( 稀)=FeSO4+ H2S↑+S↓,H2S 再将Fe3+还原,其离子方程式为_________。
(3)在溶液Y 中通入空气的目的是______________,再通入NH3后可观察到的现象是__________,若通入NH3后溶液的pH 过高,会影响产品纯度,原因是_________。
(4)操作II中除用到玻璃棒外,还需要的玻璃仪器是________。
(5)若将滤渣Z灼烧产生的尾气通入溶液X 中,充分反应后溶液的pH____(填“增大”、“减小”或“不变”)。
(6)为了测定所制备铁黄Fe2O3xH2O中x的值,用分析天平准确称量m1g样品置于坩埚中加热、冷却后称量;经过重复操作,当达到恒重时,残留固体质量为m2g,则x =______。
【答案】 适当增大稀硫酸浓度、提高反应温度、减小硫酸渣粒径 Mg2+、Ca2+ 2Fe3++H2S=2Fe2++S↓+2H+ 将Fe2+氧化成Fe3+ 产生红褐色沉淀 Mg2+转化为Mg(OH)2沉淀,降低产品纯度 烧杯、漏斗 减小 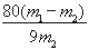
【解析】硫酸渣中含Fe2O3、CaO、MgO等,用稀硫酸溶解,过滤除去不溶物,再加FeS2发生反应FeS2+H2SO4(稀)═FeSO4+H2S↑+S↓,H2S可以将Fe3+还原为Fe2+,过滤分离,滤渣含有S、FeS2等,滤液中含有Fe2+,通入空气将Fe2+氧化成Fe3+,氨气反应得到Fe(OH)3,过滤分离,烘干得到铁黄,溶液W中含有硫酸铵等。
(1)适当增加稀硫酸浓度、提高反应温度、粉碎硫酸渣增大接触面积等,都可提高硫酸渣的溶解速度,故答案为:适当增加稀硫酸浓度、提高反应温度、粉碎硫酸渣增大接触面积;
(2)硫酸渣中含Fe2O3、CaO、MgO都能被硫酸溶解,因此溶液X中含有的金属离子有Fe3+和Mg2+、Ca2+;H2S可以将Fe3+还原为Fe2+,同时生成S,反应离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故答案为:Mg2+、Ca2+;2Fe3++H2S=2Fe2++S↓+2H+;
(3)根据上述分析,在溶液Y中通入空气可以将Fe2+氧化成Fe3+,再通入NH3后,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;若通入NH3后溶液的pH过高,Mg2+转化为Mg(OH)2沉淀,降低产品纯度,故答案为:将Fe2+氧化成Fe3+;产生红褐色沉淀;Mg2+转化为Mg(OH)2沉淀,降低产品纯度;
(4)操作Ⅱ是过滤,除用到玻璃棒外,还需要的玻璃仪器是:烧杯、漏斗,故答案为:烧杯、漏斗;
(5)滤渣Z中含有S、FeS2等,灼烧产生的尾气中含有二氧化硫气体,溶液X中含有的Fe3+能够将二氧化硫氧化生成硫酸,充分反应后溶液的酸性增强,pH减小,故答案为:减小;
(6)结晶水的质量为(m1-m2)g,则![]() =
=![]() ,解得x=
,解得x=![]() ,故答案为:
,故答案为: ![]() 。
。


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 醋酸的电离平衡常数:B点>A点
B. 由水电离出的c(OH-):B点>C点
C. 从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D. 从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 2v正(CO)=v逆(H2O)
C. 生成n molCO的同时生成n mol H2
D. 1 mol H-H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度时:2SO2(g)+O2(g)![]() 2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是
A. Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化
B. Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化
C. MgCO3电离出的CO![]() 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+ ![]() O2(g)H2O(l),反应过程中能量变化如图所示,则:
O2(g)H2O(l),反应过程中能量变化如图所示,则:
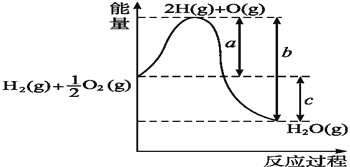
①a、b、c分别代表什么意义?
a___________________________________;
b_____________________________;
c___________________________________。
②该反应是______反应(填“吸热”或“放热”),ΔH_______0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是______。(请写两条)
(3)已知:H2(g)+ ![]() O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(l)H2(g) ΔH=+0.92 kJ·mol-1
O2(l)O2(g) ΔH=+6.84 kJ·mol-1
请写出1mol液氢和液氧生成液态水的热化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
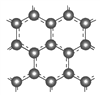
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
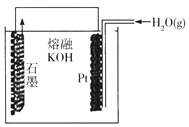
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com