
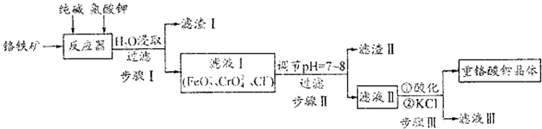
分析 铬铁矿主要成分为FeO、Cr2O3,在反应器中与纯碱、氯酸钾反应,由滤液I含有离子可知,Cl元素发生还原反应得到Cl-,而Fe元素、Cr元素均发生氧化反应得到FeO2-、CrO42-,滤液I调节pH后过滤得到滤液Ⅱ,滤液Ⅱ酸化、加入KCl,过滤分离得到重铬酸钾晶体与滤液Ⅲ,则调节PH=7~8目的是使FeO2-转化为Fe(OH)3而除去,步骤Ⅲ酸化目的是将CrO42-转化为Cr2O72-,加入KCl可以使溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7.
(1)铬铁矿在反应前进行粉碎,可以增大接触面积,加快反应速率;
(2)根据元素化合价变化判断氧化产物;
(3)由上述分析可知,步骤Ⅲ酸化目的是将CrO42-转化为Cr2O72-,加入KCl使溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7;
(4)滤渣附着的物质中含有Cr元素,用水洗涤并回收洗涤液,可以提高原料利用率,防止重金属污染;
(5)酒驾检测时,酸性K2Cr2O7将乙醇最终氧化成乙酸,同时颜色由橙色变为绿色.
解答 解:铬铁矿主要成分为FeO、Cr2O3,在反应器中与纯碱、氯酸钾反应,由滤液I含有离子可知,Cl元素发生还原反应得到Cl-,而Fe元素、Cr元素均发生氧化反应得到FeO2-、CrO42-,滤液I调节pH后过滤得到滤液Ⅱ,滤液Ⅱ酸化、加入KCl,过滤分离得到重铬酸钾晶体与滤液Ⅲ,则调节PH=7~8目的是使FeO2-转化为Fe(OH)3而除去,步骤Ⅲ酸化目的是将CrO42-转化为Cr2O72-,加入KCl可以使溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7.
(1)铬铁矿在反应前进行粉碎,可以增大接触面积,加快反应速率,
故答案为:增大接触面积,加快反应速率;
(2)反应中Fe元素化合价由-2价升高为FeO2-中+3价,Cr元素化合价由+3价升高为CrO42-中+6价,故氧化产物为:FeO2-、CrO42-,
故答案为:FeO2-、CrO42-;
(3)由上述分析可知,步骤Ⅲ酸化目的是将CrO42-转化为Cr2O72-,反应离子方程式为:2CrO42-+2H+?Cr2O72-+H2O,K2Cr2O7的溶解度小于Na2Cr2O7,发生复分解反应,加入KC1析出大量重铬酸钾晶体,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;K2Cr2O7的溶解度小于Na2Cr2O7,发生复分解反应;
(4)滤渣附着的物质中含有Cr元素,用水洗涤并回收洗涤液,可以提高原料利用率,防止重金属污染,
故答案为:提高原料利用率,防止重金属污染;
(5)酒驾检测时,酸性K2Cr2O7将乙醇最终氧化成乙酸,同时颜色由橙色变为绿色,
故答案为:乙酸;橙.
点评 本题考查物质制备实验,涉及对操作与原理的分析评价、物质的分离提纯等,关键是根据工艺流程理解制备原理,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 11.5g/mol | B. | 24.3g/mol | C. | 48.4g/mol | D. | 16.2g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加醋酸时:c(OH-)=c(Na+) | |
| B. | 加入10mL醋酸时:c(OH-)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | 加入醋酸至溶液pH=7时:c(CH3COO-)=c(Na+) | |
| D. | 加入20mL醋酸时:2c(OH-)=c(CH3COO-)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下: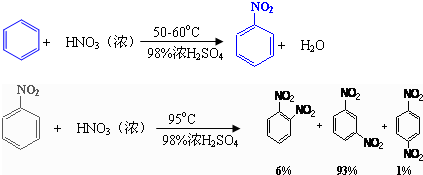
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | / | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | / | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
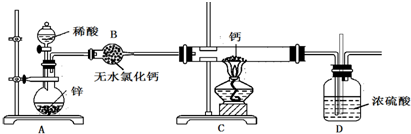
 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该分子中所有氢原子不可能在同一平面上 | |
| B. | 1mol该物质与氢气反应,最多消耗4mol氢气 | |
| C. | 加入FeCl3溶液呈紫色,因为该物质含有酚类结构特征 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,可证明结构存在碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com