
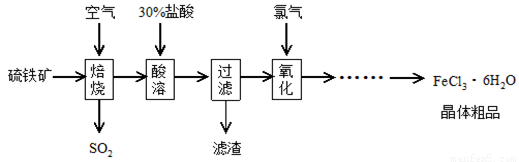
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)焙烧硫铁矿的主要方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在: 。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=
;
工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K=
;
工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作崔化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
(1)4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2 HCl(2分)
(4)取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分) ②③(2分)
【解析】
试题分析:(1)焙烧硫铁矿是硫酸工业中制取二氧化硫气体的重要步骤,发生的氧化还原反应配平比较困难,利用电子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)酸溶焙烧产物不仅是提高浸出率,还可以抑制溶解得到的Fe3+水解。
(3)因为最终要得到的产品是氯化铁晶体,所以可能焙烧不完全,仍有部分亚铁离子,所以加入氧化剂氯气氧化除去,发生的反应为Cl2+Fe2+=2Cl-+Fe3+ ,该过程可能有氯气溶于水产生挥发性的HCl以及过量的Cl2,所以可以用碱吸收。
(4)检验是否全部转化为Fe3+ ,就是检验Fe2+ 的存在,所以检验Fe2+ 可以使用高锰酸钾试剂,所以操作为:取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。
(5)氯化铁晶体(FeCl3·6H2O)含有水分,所以加热灼烧过程中,FeCl3 会发生水解并最终得到稳定的氧化物Fe2O3 。
(6)根据方程式可以写出平衡常数表达式为k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的转化率,则需要使平衡正向移动或SO2 二次利用,所以可行的是② 、③。
考点:本题考查的是工业制硫酸和化学反应原理知识。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:

| ||
| △ |
| c2(SO3) |
| c(O2)c2(SO2) |
| c2(SO3) |
| c(O2)c2(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整: + Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 ;
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,这些反应的离子方程式为 ;。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年海南省琼海市高三第一学期教学质量监测(三)化学试卷 题型:填空题
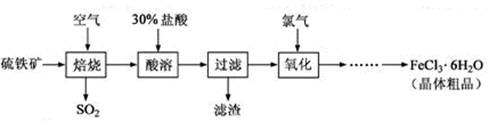
(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1) 在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。 (2)酸溶及后续过程中均需保持盐酸过量,其目的是
、
。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是
、
。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(江苏) 题型:填空题
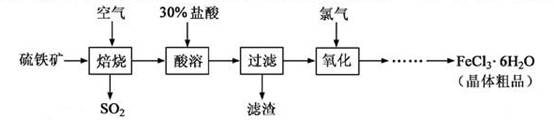
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,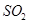 转化为
转化为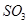 的反应为
的反应为 ,该反应的平衡常数表达式为K= ;过量的
,该反应的平衡常数表达式为K= ;过量的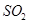 与
与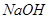 溶液反应的化学方程式为
溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为 (写化学)。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高二第二学期期末考试化学试卷 题型:填空题
(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
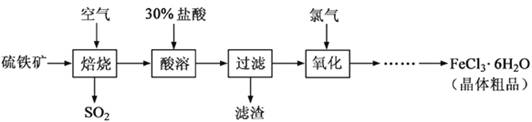
回答下列问题:
(1)硫铁矿高温焙烧的化学方程式为 ; 少量的SO2与NaOH溶液反应的离子方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和 ,
题问所涉及反应的离子方程式为 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com