
【题目】汽车尾气是产生雾霾的主要因素,对废气的综合治理是当前“打赢蓝天保卫战”的重要举措。

(1)利用某些催化剂,可实现将空气中的碳氧化物和氮氧化物转化为无毒的大气可循环物质。
已知:①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol-1
②2C(s)+O2(g)2CO(g)△H2=-221.0kJmol-1
③C(s)+O2(g)CO2(g)△H3=-393.5kJmol-1
则反应2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=______kJmol-1;某温度下,反应①、②、③的平衡常数分别为K1、K2、K3表示,则该反应的平衡常数K=______(用K1、K2、K3表示)。
(2)在同温同压下,一定量的NO和CO在不同催化剂条件下反应的能量变化如图所示。当反应进行相同的时间时,测得催化剂______(填“1”或“2”)条件下NO转化率更高,其原因是______。

(3)一定温度下,向体积为1L的密闭容器中充入NO和CO的混合气体2mol,在催化剂作用下发生反应2NO(g)+2CO(g)N2(g)+2CO2(g),达到平衡时,NO、CO的转化率及N2的体积分数为![]() 的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。
的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。

(4)利用如图所示的电解装置能将NO变废为宝,其中a、b为惰性电极。电极a的电极反应式为______。每转移3mol电子,溶液中通过质子交换膜的离子的物质的量是______mol。

【答案】-746.5 ![]() 2 催化剂2条件下活化能更低,反应速率更快,因此在相同时间NO转化率更高 b 160 NO-3e-+2H2O=4H++NO3- 3
2 催化剂2条件下活化能更低,反应速率更快,因此在相同时间NO转化率更高 b 160 NO-3e-+2H2O=4H++NO3- 3
【解析】
(1)利用盖斯定律完成;通过平衡常数的表达式得出K;
(2)从催化剂可以加快反应速率角度进行分析;
(3)根据横坐标代表![]() ,随着数值的增大,可以认为是增大n(NO),则NO的转化率降低,据此分析;利用三段式法计算出平衡常数;
,随着数值的增大,可以认为是增大n(NO),则NO的转化率降低,据此分析;利用三段式法计算出平衡常数;
(4)电极b产生H2,电极反应式为2H++2e-=H2↑,电极b为阴极,电极a为阳极,阳极上发生氧化反应,化合价升高,写出电极反应式即可,电路中通过的电量相等,从而判断出通过交换膜的离子的物质的量;
(1)利用目标反应方程式以及盖斯定律,③×2-①-②,得出△H=[(-393.5)×2+221.0-180. 5]kJ·mol-1=-746.5kJ·mol-1;①K1=![]() ,K2=
,K2=![]() ,K3=
,K3=![]() ,K=
,K=![]() ,K=
,K=![]() ;
;
(2)催化剂催化效率越高,相同时间内NO转化率越高,根据图像,催化剂2条件下活化能更低,反应速率更快,因此在相同时间NO转化率更高;
(3)横坐标代表![]() ,随着数值的增大,可以认为是提高n(NO),n(CO)不变,即NO的转化率降低,根据图像,曲线b表示NO的转化率;NO和CO的混合气体为2mol,
,随着数值的增大,可以认为是提高n(NO),n(CO)不变,即NO的转化率降低,根据图像,曲线b表示NO的转化率;NO和CO的混合气体为2mol,![]() =1,则n(NO)=n(CO)=1mol,此时NO的转化率为80%,
=1,则n(NO)=n(CO)=1mol,此时NO的转化率为80%, ,K=
,K=![]() =
=![]() =160;
=160;
(4) 电极b产生H2,电极反应式为2H++2e-=H2↑,电极b为阴极,电极a为阳极,阳极上发生氧化反应,化合价升高,NO→HNO3,即电极反应式为NO-3e-+2H2O=4H++NO3-;质子交换膜只允许H+通过,通过电量相同,因此通过质子交换膜的H+物质的量为3mol。


科目:高中化学 来源: 题型:
【题目】镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把_____(填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
______________________(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是_________,属于难溶物的电离方程式_____________________________。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a. H2O比NH3稳定 b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 d. NO中氮是+2价,氧是-2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。
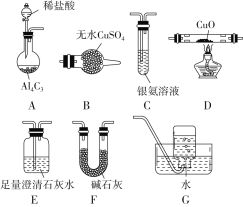
(查阅资料)
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3;
②Cu2O为红色,不与Ag+反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为__________________________。
(2)按气流方向各装置从左到右的连接顺序为A→_____________________。
(3)实验中滴加稀盐酸的操作是_________________________。
(4)已知气体产物中含有CO,则装置C中可能观察到的现象是___________________________;装置F的作用为____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______;
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量的0.1 mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需要增加对比实验,完成表中内容。
实验步骤(不要求写出具体的操作过程) | 预期现象与结论 |
________________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是______________________;
(2)(CH3CH2)2C(CH3)2的名称为___________________;
(3)2-甲基-1-丁烯的键线式__________________________;
(4)相对分子质量最小的有机物分子式_________,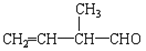 所含官能团的名称是________________;
所含官能团的名称是________________;
(5)3-甲基戊烷的一氯代产物有___________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”“摩尔”和“摩尔质量”的叙述中正确的是( )
A.物质的摩尔质量就是其相对分子(原子)质量
B.“摩尔”是国际单位制中的一个物理量
C.0.012 kg 12C中所含的碳原子数为NA
D.1 mol任何物质都含有约6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。
基态Co原子核外电子排布式为___________________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为___________________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,σ键与π键数目之比为_________。
(3)铁与K2O、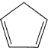 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀;加入AgNO3溶液时,没有沉淀生成;加入氢氧化钠溶液时,无气体生成。则此种配合物的化学式为 _________________________。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
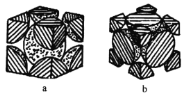
在图a所示堆积方式里铁原子的堆积方式为___________________________。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为(空间利用率)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
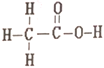 和
和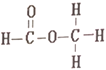
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.反应 5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4L N2 时转移的电子数为3.75NA
B.标准状况下甲烷和氧气的混合气体共22.4L,完全燃烧后的物质的分子总数一定为NA
C.将1mol Cl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA(N表示粒子数)
D.10g的D2O中含有的质子数与中子数分别为5NA 和4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为25. 00 mL,浓度均为0.0100 mol/L的HA、H3B溶液分别用0.0100mol/L NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是

A.NaOH溶液滴定HA溶液可选甲基橙作指示剂
B.均为0. 0100 mol/L HA、H3B溶液中,酸性较强的是HA
C.25℃时,0. 0100 mol/L Na2HB溶液的pH >7
D.25℃时,向Na2HB溶液中滴加HA溶液反应的离子方程式为:HB2- + HA == H2B- + A-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com