
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |

分析 (1)焓变=反应物总键能-生成物总键能;
(2)①a、b两点温度相同,压强不同,压强越大反应速率越大;
②该反应的正反应是放热反应,升高温度CO转化率降低;
③可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,分压=总压×物质的量分数;
(3)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,据此确定离子浓度的大小顺序.
解答 解:(1)反应热=反应物的总键能-生成物的总键能,则△H=2×436+x-343-413×3-465=-99,解得x=1076;
故答案为:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
故答案为:<;
②该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
故答案为:<;该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.H2的消耗速率是CH3OH生成速率的2倍均为正反应速率,不能说正逆反应速率相等,故a错误;
b.CH3OH的体积分数随着反应的进行增大,不再改变时化学平衡,故b正确;
c.混合气体的总质量不变,容器可变,则混合气体的体积减小,密度增大,不再改变时化学平衡,故c正确;
d.CO和CH3OH的物质的量之和保持不变,不能说明化学平衡,故d错误;
故答案为:bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,
Kp=$\frac{\frac{0.5}{2}×0.5}{\frac{0.5}{2}×0.5×(\frac{1}{2}×0.5)^{2}}$=1.6×10-7;
故答案为:1.6×10-7;
(3)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,设n (K2CO3)=xmol,n (KHCO3)=ymol,根据C、K原子守恒得$\left\{\begin{array}{l}{x+y=0.5}\\{2x+y=0.8}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.3}\\{y=0.2}\end{array}\right.$,
即n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,且碳酸根离子水解程度大于碳酸氢根离子,但其水解程度都较小,所以c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),
故答案为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).
点评 本题考查电解原理、化学平衡计算、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析、判断及计算能力,明确化学平衡状态判断方法、外界条件对化学平衡移动影响、盐类水解等知识点是解本题关键,难点是(3)题计算.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
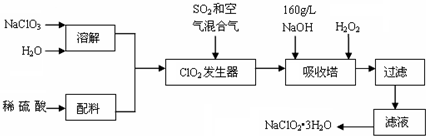
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
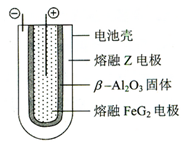 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: .
. 2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com