
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是①Cl2 ②NO2 ③H2S ④SO2 ⑤溴蒸气 ⑥HCl中的 ( )
A.①④⑤ B.①②⑤ C.①②⑥ D.①②④⑤
科目:高中化学 来源: 题型:
【题目】人类对于晶体结构的持续探究揭开了晶体内部的奥秘,并合成了许许多多的新物质、新材料。回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
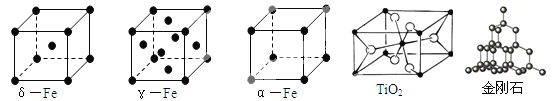
(2)TiO2的天然晶体中,最稳定的一种晶体结构如上图,白球表示: 原子。
(3)NaCl、CO2、SiO2三种晶体熔点由低到高的顺序是 。
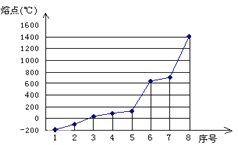
(4)第三周期八种元素按单质熔点由低到高的顺序排列如图所示,其中序号1和8分别代表的是 和 。
(5)已知:Cr3+可形成配位数为6的配合物。组成为CrCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 (选填代号)。
A.[CrCl(H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]·3H2O
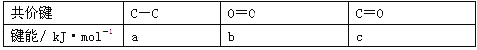
(6)根据下表所示键能,写出金刚石(结构如上图)完全燃烧时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届怀化一模】燃料的使用和防污染是社会发展中一个无法回避的矛盾话题。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-860.0 kJ·mol-1
②2NO2(g)![]() N2O4(g) ΔH2=-66.9 kJ·mol-1
N2O4(g) ΔH2=-66.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)、CO2的热化学方程式:___________________。
(2)如将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
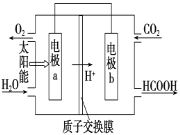
电极a、b表面发生电极反应。其中a极为:_______极,b其电极反应式为: _________________。
(3)如果用100ml 1.5mol/L的NaOH溶液吸收2.24L(标准状况)的二氧化碳气体所得溶液中各离子浓度由大到小的顺序为__________________(用离子浓度符号表示)。
(4)燃料除硫中可用到CaCO3,它是一种难溶物质,其Ksp=2.8×10—9。
①)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4·2H2O)。写出该反应的化学方程式:_____________。
②有一纯碱溶液的浓度为2×10—4mo1/L,现将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A–)不变
C.当pH为5.0时,饮料中![]() =0.16
=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(![]() )+c(
)+c(![]() )+c(OH–)–c(HA)
)+c(OH–)–c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
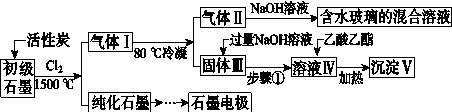
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是 。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为 。由气体Ⅱ中某物得到水玻璃的化学反应方程式为 。
(3)步骤①为:搅拌、 。所得溶液Ⅳ中的阴离子有 。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为 ,
100kg初级石墨最多可能获得Ⅴ的质量为 kg。
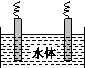
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
(1)用铜作阳极,钦片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,有关转化如图所示。

将得到的Cu2O溶于稀硫酸,发现有红色固体生成,该反应中氧化剂与还原剂的质量之比为___________。图中③④两步反应的总反应离子方程式为________________。
(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1;按![]() 的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。
的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。

①图中压强pl、p2、p3由大到小的顺序是_________。
②a _________(填“>”或“<”) 0。
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡,该温度下反应的平衡常数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届临沂一模】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
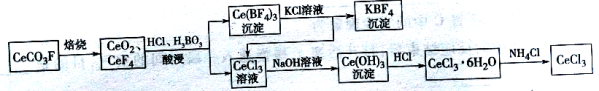
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式: 。
(3)向Ce(BF4)3中加入KCl溶液的目的是 。
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的pH为 。
(已知KSP[Ce(OH)3]=1×10-20)
(5)加热CeCl3 .6H2O和NH4Cl的固体混合物可得到无水CeCl3 ,其中NH4Cl的作用是____________。
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=Ce3++Fe3+)
①该样品中CeCl3的质量分数为 。
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数 (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
![]()
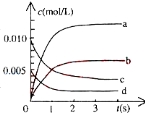
(1)写出该反应的平衡常数表达式:K=___________________。已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是_______。用O2表示从0~2s内该反应的平均速率v=_________。
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com