
分析 氯化铁为强酸弱碱盐,水解呈酸性,加入碳酸钙,碳酸钙与水解生成的氢离子反应生成二氧化碳,溶液中水解平衡正向进行生成,产生更多氢氧化铁沉淀,以此解答;
解答 解:氯化铁为强酸弱碱盐,氯化铁水解呈酸性,离子方程式:Fe3++3H2O?Fe(OH)3+3H+,加入碳酸钙,碳酸钙与水解生成的氢离子反应生成二氧化碳,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀,所以看到的现象为碳酸钙逐渐溶解,同时产生的现象还有:①有无色无味气体生成;②溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;
用离子方程式表示产生上述现象的原因:Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:①有无色无味气体生成;②溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O.
点评 本题考查了盐类的水解应影响水解平衡移动的因素,明确盐类水解规律及化学平衡移动影响因素是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用10 mL 量筒量取5.25 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH值为12.5 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 配制70mL 0.1 mol/L的稀硫酸选用100 mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液, 振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②, 振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
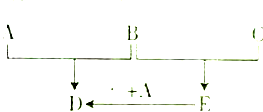 已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):
已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com