

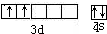
 该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,
该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族, ;1s22s22p63s23p63d24s2;第四周期、第ⅣB族;
;1s22s22p63s23p63d24s2;第四周期、第ⅣB族;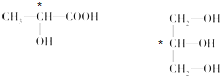 ,故答案为:
,故答案为: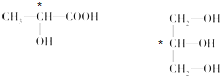 .
.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| A、阴极只析出氢气 |
| B、阳极先析出氯气后析出氧气 |
| C、电解最后阶段为电解水 |
| D、电解过程中溶液的PH不断增大,最后PH为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
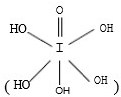 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:I
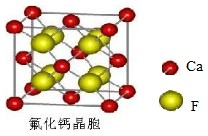
查看答案和解析>>
科目:高中化学 来源: 题型:
| w(X) | w(Y) | 101.3kPa、t℃时密度(g/L) | 沸点(℃) | |
| A | 0.111 | 0.889 | 1000(4℃) | 100 |
| B | 0.200 | 0 | 1.34(0℃) | -88.6 |
| C | 0.125 | 0.500 | - | 64. 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
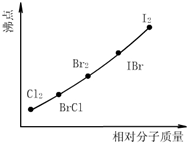 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电极一定要由两种不同的金属组成 |
| B、电子流出的一极是正极 |
| C、两极均发生氧化还原反应 |
| D、由化学能转化为电能的装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com