
| �¶ȣ��棩 | 10 | 20 | 30 | ������к���ȴ��50�� |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
���� ��1��NaHCO3Ϊǿ�������Σ�����Һ�з�����HCO3-+H2O?H2CO3+OH-��ˮ��ʼ��ԣ�����ʱ��NaHCO3�ɷֽ�����Na2CO3��Na2CO3ˮ��̶Ƚϴ���Һ���Խ�ǿ��
��2�������Ȼ�����Һ�������ɳ�����˵����ͬѧ������ȷ��
��3����ѹ�¼���NaHCO3��ˮ��Һ����Һ���¶ȴﲻ��150�森
��� �⣺��1��NaHCO3Ϊǿ�������Σ�����Һ�з�����HCO3-+H2O?H2CO3+OH-��ˮ��ʼ��ԣ�����ʱ��NaHCO3�ɷֽ�����Na2CO3��Na2CO3ˮ��̶Ƚϴ���Һ���Խ�ǿ��
�ʴ�Ϊ��HCO3-+H2O?H2CO3+OH-�����ڣ�
��1�������Ȼ�����Һ�������ɳ�����˵����Һ�д��ڴ�����CO32-����ͬѧ������ȷ��������A��D�����ɳ�������ȷ������C������ѡ�Լ�B��
�ʴ�Ϊ���ң�B��
��2����NaHCO3�ķֽ��¶�Ϊ150�棬���ҵĽ��ۿ϶�����ԭ���dz�ѹ�¼���NaHCO3��ˮ��Һ����Һ���¶ȴﲻ��150�棬
�ʴ�Ϊ���ң���ѹ�¼���NaHCO3��ˮ��Һ����Һ���¶ȴﲻ��150�森
���� ���⿼���Ϊ�ۺϣ��漰�����ˮ���ʵ�鷽�������ۣ�������ѧ����ʵ�����������������Ŀ��飬ע���������ˮ���ԭ�����ɣ��������ʵ����ʣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� ��25��C���� | Ki=1.77��10-4 | Ki=4.9��10-18 | Ki1=4.3��10-7 Ki2=5.6��10-11 |
| A�� | CN-+H2O+CO2��HCN+HCO3- | |
| B�� | 2HCOOH+CO32-��2HCOO-+H2O+CO2�� | |
| C�� | �к͵��������pH��HCOOH��HCN����NaOH����ǰ�ߴ��ں��� | |
| D�� | ���������Ũ�ȵ�HCOONa��NaCN��Һ��������������ǰ��С�ں��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��mol��Cl2������Fe��Ӧ��ת�Ƶĵ�����Ϊ3NA | |
| B�� | 3mol NO2������H2O��Ӧ��ת�Ƶĵ�����ΪNA | |
| C�� | 0.1mol/L������������Һ�к���������Ϊ0.1NA�� | |
| D�� | 0.30mol Fe��������ˮ������Ӧ���ɵ�H2������Ϊ0.40NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���� | �Լ� | ��Ҫ���� | |
| A | SiO2 | Fe2O3 | ���� | ���� |
| B | Mg | Al | NaOH | ���� |
| C | FeCl2 | FeCl3 | Cu | ���� |
| D | KNO3 | KCl | H2O | ��ȴ�ᾧ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 17g NH3��18 g H2O�к��еĵ�������Ϊ10NA | |
| B�� | 2 L 1.5 mol•L-1������Һ�к��е�CH3COO-��Ϊ3NA | |
| C�� | ��״���£�5.6 L Cl2�ܽ�������NaOH��Һ�У�ת�Ƶĵ�����Ϊ0.5NA | |
| D�� | ��ѹ�ܱ������г���2 mol NO��1 mol NO2�������з�����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������а���ȼ�գ�������ɫ���� | |
| B�� | ��˿��������ȼ�գ������غ�ɫ���� | |
| C�� | ͭ˿��������ȼ�գ������ػ�ɫ���� | |
| D�� | ����������ȼ�գ�������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
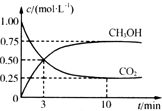 ������̼�ǵ�������ЧӦ��������ף�Ŀǰ���Ǵ���������̼�ķ���֮һ��ʹ����������Ӧ�ϳɼ״�����֪�������״�ȼ�յ��Ȼ�ѧ����ʽ���£�
������̼�ǵ�������ЧӦ��������ף�Ŀǰ���Ǵ���������̼�ķ���֮һ��ʹ����������Ӧ�ϳɼ״�����֪�������״�ȼ�յ��Ȼ�ѧ����ʽ���£�| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol/L�� | 0.44 | 0.6 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢ڢۢܢ� | C�� | �٢ڢۢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com