
【题目】黄铜矿的主要成分是CuFeS2(硫元素﹣2价,铁元素+2价).实验室用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如图: 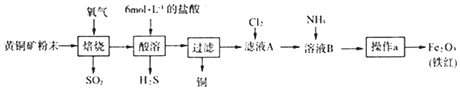
已知:CuFeS2+O2 ![]() Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
(1)实验室制氯气的化学方程式为 .
(2)SO2和H2S有毒,会造成大气污染.
①已知SO2和H2S混合可以得到单质硫.为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为 .
为检验某尾气中是否含有SO2、CO2、CO三种气体,实验小组同学用如下装置设计实验.
选择上述装置(可以重复),按照气流方向其连接顺序为A→(填序号).
(3)PbO2具有强氧化性,可与浓盐酸反应制取氯气.
①上述反应化学方程式为;由PbO与次氯酸钠溶液反应可制得PbO2 , 反应的离子方程式为 .
②Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.Na2S2O3在溶液中被Cl2氧化成SO42﹣ , 则该反应的化学方程式为 .
③本实验存在的一个缺陷是 .
(4)按上述流程用150g黄铜矿粉末可制得48gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是(假设各步反应均完全进行且过程中无额外物质损耗).
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)1:2;B→C→D→E→C
(3)PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O;PbO+ClO﹣=PbO2+Cl﹣;Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4;引起重金属离子污染
PbCl2+Cl2↑+2H2O;PbO+ClO﹣=PbO2+Cl﹣;Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4;引起重金属离子污染
(4)73.6%
【解析】解:(1)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,反应的方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)SO2和H2S混合反应生成单质硫和水,反应方程式为:SO2+2H2S=3S↓+2H2O,所以为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为1:2;为检验某尾气中是否含有SO2、CO2、CO三种气体,则按照先检验SO2 , 后除去SO2 , 再检验CO2 , 除去CO2 , 最后用CuO在加热条件下检验CO,又A中品红溶液检验SO2 , B中酸性高锰酸钾除去SO2 , C中澄清石灰水检验CO2 , D中碱石灰除去CO2 , E中CO与CuO在加热条件下生成铜和CO2 , 最后再通入C中澄清石灰水检验有CO2生成,所以连接顺序为A→B→C→D→E→C;所以答案是:1:2;B→C→D→E→C;(3)①由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,反应方程式为:PbO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;(2)SO2和H2S混合反应生成单质硫和水,反应方程式为:SO2+2H2S=3S↓+2H2O,所以为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为1:2;为检验某尾气中是否含有SO2、CO2、CO三种气体,则按照先检验SO2 , 后除去SO2 , 再检验CO2 , 除去CO2 , 最后用CuO在加热条件下检验CO,又A中品红溶液检验SO2 , B中酸性高锰酸钾除去SO2 , C中澄清石灰水检验CO2 , D中碱石灰除去CO2 , E中CO与CuO在加热条件下生成铜和CO2 , 最后再通入C中澄清石灰水检验有CO2生成,所以连接顺序为A→B→C→D→E→C;所以答案是:1:2;B→C→D→E→C;(3)①由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,反应方程式为:PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O;PbO与次氯酸钠溶液反应,PbO为还原剂生成PbO2 , 次氯酸根为氧化剂生成氯离子,离子方程式为:PbO+ClO﹣=PbO2+Cl﹣ , 所以答案是:PbO2+4HCl(浓)
PbCl2+Cl2↑+2H2O;PbO与次氯酸钠溶液反应,PbO为还原剂生成PbO2 , 次氯酸根为氧化剂生成氯离子,离子方程式为:PbO+ClO﹣=PbO2+Cl﹣ , 所以答案是:PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O;PbO+ClO﹣=PbO2+Cl﹣;
PbCl2+Cl2↑+2H2O;PbO+ClO﹣=PbO2+Cl﹣;
②Na2S2O3在溶液中被Cl2氧化成Na2SO4 , 氯气被还原成氯化钠,根据得失电子守恒和原子守恒,反应的化学方程式为:Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4;所以答案是:Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4;
③铅为重金属元素,会引起重金属污染,所以PbO2具有强氧化性,可与浓盐酸反应制取氯气,生成PbCl2会引起重金属离子污染,所以答案是:引起重金属离子污染;(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3 , 所以该黄铜矿中含CuFeS2的质量分数= ![]() ×100%=73.6%,所以答案是:73.6%.
×100%=73.6%,所以答案是:73.6%.


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3?H2O═Al(OH)3↓+3NH ![]()
B.存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( ) 
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
A.26g
B.36g
C.104g
D.37.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧洲核子研究中心于1995年9月~10月间研制成世界上第一批反原子——共9个反氢原子,揭开了人类制取、利用反物质的新篇章。则下列关于反氧原子说法正确的是( )
A.核内有8个带正电的质子,核外有8个带负电的电子
B.核内有8个带负电的电子,核外有8个带正电的质子
C.核内有8个带负电的中子,核外有8个带正电的质子
D.核内有8个带负电的质子,核外有8个带正电的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2 , 则原混合物中KClO3的质量为g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
(a)求25℃时KCl的溶解度;
(b)求原混合物中KClO3的质量;
(c)所得KCl溶液的密度为1.72g/cm3 , 则溶液的物质的量浓度为多少?(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为 .
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com