
铝是一种应用广泛的金属,工业上用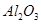 和冰晶石(
和冰晶石(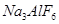 )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是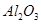 和
和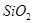 等。从铝土矿中提炼
等。从铝土矿中提炼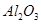 的流程如下:
的流程如下: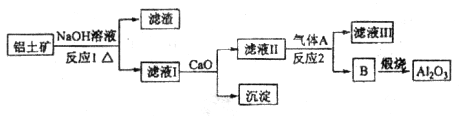
②以萤石(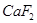 )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下: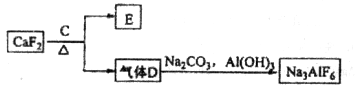
回答下列问题:
(1)写出反应1的化学方程式_________________________、________________________________;
(2)滤液Ⅰ中加入 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________
(3)E常用作制作豆腐的添加剂,化合物C是____,写出由D制备冰晶石的化学方程式_______________;
(1)2NaOH+SiO2=Na2SiO3+H2O 2NaOH+Al2O3=2NaAlO2+H2O
(2)CaSiO3(2分) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(2分)
(3)浓H2SO4(1分) 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(2分)
解析试题分析:由铝土矿的成分及流程图分析知,第一步发生的反应为氧化铝、二氧化硅和氢氧化钠溶液反应,2NaOH+Al2O3=2NaAlO2+H2O;2NaOH+SiO2=Na2SiO3+H2O,滤渣成分为二氧化硅,滤液I的主要成分是NaAlO2和Na2SiO3,加入生石灰发生的反应:CaO+H2O=Ca(OH)2和Ca(OH)2 +Na2SiO3=CaSiO3+ 2NaOH,即沉淀为CaSiO3。滤液II的主要成分是NaAlO2,通入的气体A是CO2,发生反应的方程式为2NaAlO2+CO2+3H2O=2A l ( O H )3↓+Na2CO3;物质B为氢氧化铝,煅烧的氧化铝。由上述分析知,(1)反应1的化学方程式为2NaOH+SiO2=Na2SiO3+H2O,2NaOH+Al2O3=2NaAlO2+H2O;(2)滤液I的主要成分是NaAlO2和Na2SiO3,加入生石灰发生的反应:CaO+H2O=Ca(OH)2和Ca(OH)2 +Na2SiO3=CaSiO3+ 2NaOH,即沉淀为CaSiO3。滤液II的主要成分是NaAlO2,通入的气体A是CO2,发生反应的方程式为2NaAlO2+CO2+3H2O=2A l ( O H )3↓+Na2CO3;(3)根据E常用作制作豆腐的添加剂,为硫酸钙,加入C能和CaF2 发生反应生成硫酸钙,可知C是浓硫酸,反应的方程式为CaF2+H2SO4(浓) CaSO4+2HF;气体D为氟化氢,根据题给信息写出方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
CaSO4+2HF;气体D为氟化氢,根据题给信息写出方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
考点:以化学工艺流程为载体考查常见物质的性质及化学方程式的书写。


科目:高中化学 来源: 题型:填空题
向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: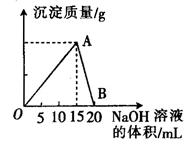
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3溶液的物质的量浓度是______________。
(5)当所得沉淀量为0.39克时,用去NaOH溶液的体积是_____ mL 或_______ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯: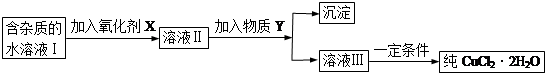

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为 .
(2)转化②的化学方程式为 .转化③的离子方程式为 .
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 (填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
向溶液B中加入CuO的作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)写出制备G的化学反应方程式。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。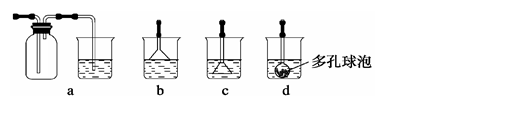
(4)欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: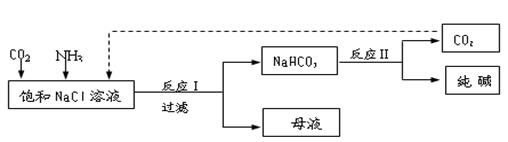 k+s-5#
k+s-5#
已知NaHCO3在低温下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 _____________________________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。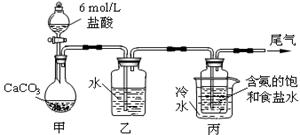
(1)装置丙中冷水的作用是 ;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 ;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是 ;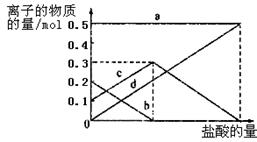
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol?L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题: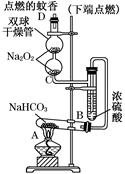
(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是__________________________________。
(3)在双球干燥管内发生反应的化学方程式为_______________。
(4)双球干燥管内观察到的实验现象是__________________________
____________________________________________________________________。
上述实验现象说明________________________________________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。
请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com