
| A. | 质量数是6 | B. | 质子数是6 | C. | 电子数是14 | D. | 中子数是14 |
科目:高中化学 来源: 题型:解答题
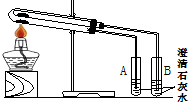 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与14N互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. | CH4与(CH3)2CHCH3互为同系物 | D. | H2O与D2O互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
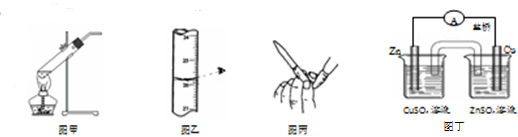
| A. | 用图甲所示装置加热分解NaHCO3固体 | |
| B. | 用图乙所示读取滴定管读数 | |
| C. | 用图丙所示排碱式滴定管尖嘴内的气泡 | |
| D. | 用图丁所示装置构成铜锌原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
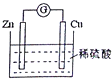
| A. | Zn片是正极 | |
| B. | 电池工作时,H+在铜片上得电子 | |
| C. | 电池工作时,电能转变为化学能,且锌片逐渐被消耗 | |
| D. | 电池工作时,电子从锌片通过硫酸溶液流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:H2S在高温下分解生成硫蒸气和H2.现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示,则生成的硫蒸气化学式为( )
已知:H2S在高温下分解生成硫蒸气和H2.现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示,则生成的硫蒸气化学式为( )| A. | S | B. | S2 | C. | S6 | D. | S8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
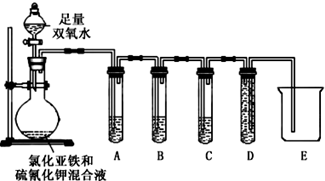
| 实验过程和现象 | 结论 |
| (2)试管A中盛有品红溶液现象:品红溶液褪色 | 证明气体中含有SO2 |
| (3)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅试管C中现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
| 实验过程 | 实验现象及结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com