
利用如图装置测定中和热的实验步骤如下:
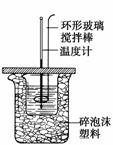
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):________________________________________________________________________
________________________________________________________________________。
(2)倒入NaOH溶液的正确操作是______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______(从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温 度t2/℃ | 温度差平均值(t2-t1) /℃ | |
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
②近似认为0.55 mol·L-1 NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=
________________________________________________________________________
( 取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)
____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
答案 (1)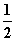 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===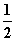 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)C (3)D
(4)①3.4 ②-56.8 kJ·mol-1 ③acd
解析 (1)中和热测定实验要求尽可能减少热量损失,且保证酸和碱能充分反应,即要有一种反应物过量。
(2)NaOH溶液应一次倒入,以减少热量损失。
(3)温度计不能用来搅拌试剂,B项有热量损失,C项不可避免有液体溅出。
(4)①第2次实验的温度差与其它3次相比差别太大,应舍去;②ΔH=-(100 g×4.18×10-3 kJ·g-1·℃-1×3.4℃)÷0.025 mol=-56.8 kJ·mol-1;③测得结果小于理论值,即在实验过程中有热量损失,故a、c、d正确。


科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图
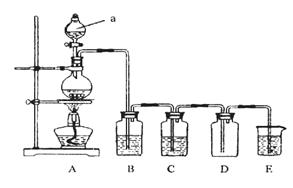
(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)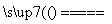 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+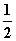 O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+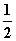 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:________________________________________________________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
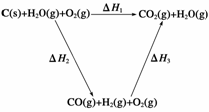
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________(填“甲”或“乙”);判断的理由是________________________________________________________________________
________________________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:________________________________________________________________________
________________________________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25°C、100 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+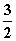 O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活动性顺序由大到小排列为( )
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图所示的反应判断下列说法中错误的是( )
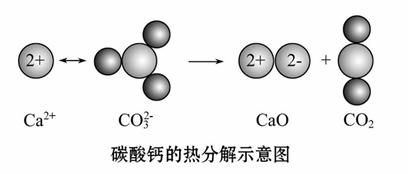
A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B.该反应的焓变大于零
C.该反应中有离子键断裂也有共价键断裂
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是
( )
A.FeCl2、FeCl3 B.FeCl2、Fe2(SO4)3
C.Na[Al(OH)4]、AlCl3 D.Mg(HCO3)2、MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com