

| A. | 装置①可用于分离I2与NH4Cl混合物 | |
| B. | 装置②收集并测量Cu与浓硫酸反应产生的气体的体积 | |
| C. | 装置③制取氯气 | |
| D. | 装置④制取无水MgCl2 |
分析 A.I2受热会升华,遇冷会凝华转化为固体I2;NH4Cl受热会分解产生NH3和HCl,遇冷又化合为NH4Cl;
B.二氧化硫能和水反应生成亚硫酸;
C.浓盐酸和二氧化锰在加热条件下反应生成氯气;
D.氯化镁是强酸弱碱盐,易水解生成HCl,所以HCl能抑制其水解.
解答 解:A.I2受热会升华,遇冷会凝华转化为固体I2;NH4Cl受热会分解产生NH3和HCl,遇冷又化合为NH4Cl,用装置①无法分离,故A错误;
B.Cu与浓硫酸反应生成SO2,SO2能溶于水并有部分和水发生反应,故不能用装置②收集并测量气体体积,故B错误;
C.浓盐酸与MnO2反应制取Cl2,反应需要在加热条件下进行,故C错误;
D.MgCl2在加热水会发生水解反应生成Mg(OH)2和HCl,故需在HCl的氛围中加热制取无水MgCl2,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、气体收集、气体制备、盐类水解等知识点,明确实验原理及物质性质是解本题关键,会根据反应物状态和条件选取制取气体的反应装置、根据气体溶解性及密度确定收集方法,易错选项是D.


科目:高中化学 来源: 题型:解答题
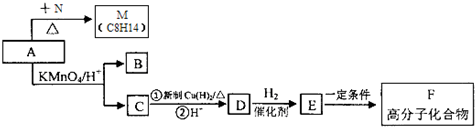
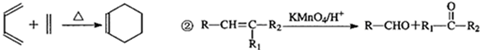
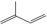 ,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构).
,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构). .
.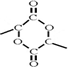 含有三元环:
含有三元环: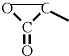 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl发生状态变化时,一定会破坏离子键 | |
| B. | 元素的非金属性越强,单质的活泼性一定越强 | |
| C. | 物质中分子间的作用力越大,分子越稳定 | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
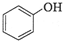
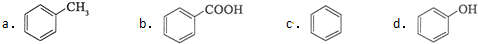
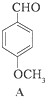 $→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$
$→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$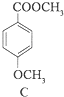
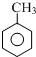 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$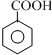
 .
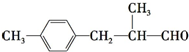
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使溴水褪色的物质一定能和溴水发生加成反应 | |
| B. | 天然蛋白质水解的最终产物是多种α-氨基酸 | |
| C. | 能发生银镜反应的物质都是醛 | |
| D. | 棉花和蚕丝的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 g | |
| B. | 1 mol CO2的体积是22.4 L | |
| C. | 0.2 mol H2O的质量是3.6 g | |
| D. | 0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com