
| A. | KI | B. | 浓氨水 | C. | 冰醋酸 | D. | 热水 |
分析 水为弱电解质,溶液中存在电离平衡:H2O?H++OH-,加入酸或碱会抑制水的电离,加入能水解的盐促进水的电离;水的电离为吸热反应,升高温度会促进水的电离,据此分析解答.
解答 解:A.KI是强酸强碱盐,KI不水解,所以不影响水电离,故A选;
B.一水合氨是弱电解质,在水溶液中电离出氢氧根离子而抑制水电离,故B不选;
C.冰醋酸是酸,在水溶液中电离出氢离子而抑制水电离,故C不选;
D.水的电离是吸热反应,升高温度促进水电离,所以影响水电离,故D不选.
故选A.
点评 本题考查水电离影响因素,明确水电离特点是解本题关键,知道酸溶液和碱溶液抑制了水的电离,能够水解的盐促进了水的电离,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属烃类化合物 | B. | 常温下是固态 | ||
| C. | 可发生氧化、加成反应 | D. | 可能含381个碳碳叁键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
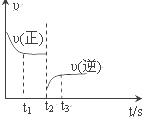 合成氨反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 △H=-92.4kJ•mol.
合成氨反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 △H=-92.4kJ•mol.| A. | 升高温度 | B. | 分离出部分氨气 | C. | 降低压强 | D. | 增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
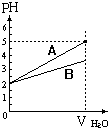 pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )
pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )| A. | 等体积pH=2的两种酸中和NaOH的能力酸A比酸B强 | |
| B. | A为弱酸,B为强酸 | |
| C. | 酸B的摩尔浓度比酸A大 | |
| D. | A比B易电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极发生的反应只有:2Cl--2e-═Cl2↑ | |
| B. | 两极得到的气体均为混合气体 | |
| C. | 若Cu2+起始浓度为l mol•L-l,则C1-起始浓度为2 mol•L-1 | |
| D. | Cu2+的起始物质的量应小于0.75 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com