
| A. | K越大,反应速率越大 | |
| B. | 对任一给定的可逆反应,温度升高,K值增大 | |
| C. | 对可逆反应,K值越大,反应物的转化率越高 | |
| D. | 加入催化剂或增大反应物浓度,K值将增大 |
科目:高中化学 来源: 题型:实验题
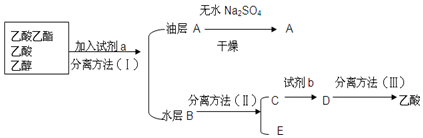
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量CO2通入Na2SiO3溶液中会生成沉淀 | |
| B. | Li在氧气中充分燃烧,产物为Li2O | |
| C. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色 | |
| D. | 将过量的CO2气体通到NaAlO2溶液中可生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | Ca(OH)2+SO2═CaSO3+H2O | |
| D. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入Ca(ClO)2溶液中:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| B. | 氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 向FeCl3溶液中加入铜粉:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
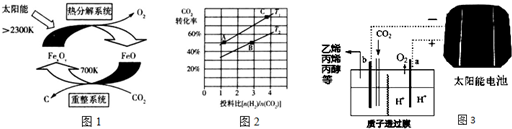
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com