
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)①氮氧化物形成酸雨是硝酸型酸雨;
②高温会引发N2和O2反应生成一氧化氮;
(2)硫酸型酸雨是二氧化硫和水反应生成亚硫酸,亚硫酸被空气中的氧气氧化为硫酸,酸雨的酸性增强;
(3)①钙基固硫法:CaO+SO2+O2=CaSO4;
②二氧化硫是酸性氧化物,碳酸钠溶液可以吸收,生成亚硫酸氢钠或亚硫酸钠和氨水碱性溶液可以吸收二氧化硫;
(4)依据溶液中电荷守恒计算,c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)结合图表数据计算.
解答 解:(1)①NOx能形成酸雨,由NO2形成的酸雨为硝酸型酸雨,硝酸溶液中含有的主要离子有H+、NO3-,
故答案为:H+、NO3-;
②汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(2)硫酸型酸雨是二氧化硫和水反应生成亚硫酸,亚硫酸被空气中的氧气氧化为硫酸,酸雨的酸性增强,反应的化学方程式为:2H2SO3+O2=2H2SO4,
故答案为:2H2SO3+O2=2H2SO4;
(3)①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,是氧化钙和二氧化硫反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙,CaO+SO2+O2=CaSO4,最高价态的化合物为CaSO4,
故答案为:CaSO4;
②二氧化硫是酸性氧化物,
a、Na2CO3溶液可以吸收二氧化硫,生成亚硫酸钠和二氧化碳,故a正确;
b、硫酸不能吸收二氧化硫,故b错误;
c、NaHSO3不能吸收二氧化硫,故c错误;
d.NH3•H2O能吸收二氧化硫生成亚硫酸铵或亚硫酸氢铵,故d正确;
故答案为:ad;
(4)溶液中存在电荷守恒c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-),结合图表数据计算得到氢离子浓度c(H+)=1×10-4 mol/L,
故答案为:1×10-4.
点评 本题考查了硝酸根离子结构,氮氧化物性质的分析应用,钙基固硫原理的理解分析,掌握基础注意积累知识是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯化氢气体不能导电,所以氯化氢不是电解质 | |
| B. | SO2溶于水形成的溶液能导电,所以SO2是电解质 | |
| C. | 碳棒能导电但属于非电解质 | |
| D. | 电解质不一定能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
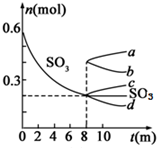 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Ba(NO3)2溶液中能生成BaSO4沉淀 | |
| B. | 在Si02+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2C0的反应中,Si02是氧化剂 | |
| C. | 生铁在潮湿的空气中主要发生析氢腐蚀 | |
| D. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
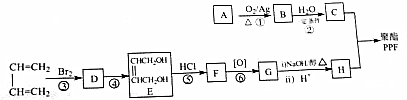

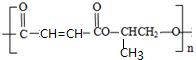 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片上出现铜绿[Cu2(OH)2CO3] | B. | 铁制菜刀生锈 | ||
| C. | 铝锅表面生成致密的氧化膜 | D. | 用醋清理水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com