
25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)?根据图示判断,下列说法中正确的是

A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
B
【解析】
试题分析:A.当V(NaOH)=20mL时,发生反应:NaOH+H2A=NaHA+H2O。所得溶液是NaHA。由于HA-在溶液中存在电离作用和水解作用,电离产生H+使溶液显酸性,水解消耗H+,使溶液显碱性。由于此时溶液中c(H2A)< c(A2-),说明水解作用很弱,电离占优势,故 (OH-)<c(H+),错误。B.当V(NaOH)=30mL时,所得溶液是NaHA、Na2A等浓度的混合溶液。根据图像可知c(HA-) < c(A2-),说明c(HA-)的电离程度大于c(A2-)的水解程度。溶液显酸性。根据物料守恒可得:2 c(Na+)=3c(A2-)+ 3c(HA-)+3c(H2A)。根据电荷守恒可得c(H+)+ c(Na+)=c(OH-)+2 c(A2-)+c(HA-)。将第二个式子扩大2倍,与第一个式子相减,整理可得2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-),正确;C.当V(NaOH)=40mL时,酸碱恰好完全中和,产生Na2A。由于该盐是强碱弱酸盐,A2-发生水解反应而消耗,水电离产生的H+被消耗,最终当溶液中的水达到电离平衡时,c(OH-)> c(H+)。由于溶液中除了A2-、HA-水解产生OH-外,还存在水电离产生的OH-。所以c(OH-)> c(HA-) 。故溶液中离子浓度大小关系正确的是所得溶液中:c(Na+)> c(A2-) > c(OH-)> c(HA-)>c(H+),错误。
考点:考查酸碱发生中和反应时溶液中离子浓度大小比较的关系的知识。


科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:填空题
(6分)实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol。
(2)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
下列实验操作、现象和原因解释不合理的是
选项 | 实验操作 | 实验现象 | 原因解释 |
A. | 将一片较簿的铝片放在酒精灯火焰上灼烧 | 铝片慢慢熔化呈液滴状 | 铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低熔化了 |
B. | 将等表面积的镁条、铝片(均除去氧化膜)分别放入装有等浓度、等体积盐酸的两支试管中 | 都产生气泡,镁条表面产生气泡更快 | 镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快 |
C. | 在打磨过的铁片上先滴一滴饱和食盐水,再滴一滴酚酞 | 液滴的外圈先出现红色 | 铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增大,溶液呈碱性 |
D. | 取少量淀粉加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,加热至沸腾 | 未见砖红色沉淀生成 | 淀粉水解后没有葡萄糖生成 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:推断题
(14分)在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出) 请回答下列问题:

(1)形成单质D的元素在周期表中的位置
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)
(3)C长期暴露在空气中,最终产物是
(4)H在高温下与碳反应方程式为 ,若转移4mol电子参加反应的碳为 mol。
(5)写出反应①的离子方程式
(6)写出反应②的化学方程式
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:填空题
(16分)氨、硝酸、硝酸铵、硝酸铜是重要的化工产品。工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)吸收塔中通入空气的作用是 。
下列可以代替硝酸镁加入到蒸馏塔中的是 。
A.浓硫酸 B.氯化钙 C.生石灰 D.硝酸亚铁
(2)制硝酸尾气中的氮氧化物常用尿素[CO(NH2)2]作为吸收剂,其主要的反应为:NO、NO2混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出反应的化学方程式 、 。
(3)在氧化炉里,催化剂存在时氨气和氧气反应:
4NH3 + 5O2 4NO + 6H2O 4NH3 + 3O2
4NO + 6H2O 4NH3 + 3O2 2N2+ 6H2O
2N2+ 6H2O
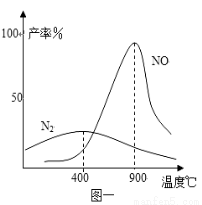
在不同温度时生成产物如图一所示。在氧化炉里,反应温度通常控制在800℃~900℃的理由是 。

(4)如图二所示装置可用于电解NO制备 NH4NO3,电解总反应方程式为 ,需补充氨气的理由是 。
(5)工业上通常用铜与浓硝酸反应制得光谱纯硝酸铜晶体(化学式为Cu(NO3)2·3H2O,摩尔质量为242g/mol)。已知:25℃、1.01×105 Pa时,在密闭容器发生反应:2NO2 N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。
N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。
现用一定量的Cu与足量的浓高纯度硝酸反应,制得5.00 L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105 Pa),理论上生成光谱纯硝酸铜晶体的质量为________ g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
化学知识与日常生活密切相关。下列说法不正确的是
A.镀锡铁板比镀锌铁板更耐腐蚀
B.水常温下呈液态,冰浮在水面上,均与氢键有关
C.用纯碱溶液清洗油污时,加热可增强其去污能力
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
已知反应:①SeO2+4KI+4HNO3 =Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
化学实验中需要现用现配的试剂,其失效原因与氧化还原反应无关的是
A.硫化钠溶液 B.氯水
C.硫酸亚铁溶液 D.氢氧化铜悬浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com