
【题目】A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。
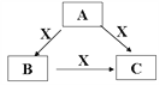
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________(写元素名称),它在周期表中的位置为_____________。
②写出B → C反应的离子方程式为___________________________________。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________、_________。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 ____________ g 。
【答案】 铝 第3周期第ⅢA族 Al(OH)3 + OH— = AlO2— + 2H2O Fe + 4H+ + NO3— = Fe3+ + NO↑ + 2H2O 离子键、(极性)共价键 100mL容量瓶 胶头滴管 2.65
【解析】(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可以知道,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;据此分析解答。
(2)铁与稀硝酸反应生成硝酸铁和一氧化氮气体。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,据此分析解答。
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可以知道,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A、B、C中含有的同一种常见金属元素为Al,在周期表中位置是第三周期,ⅢA族;正确答案: 铝;第三周期IIIA族。
②A的水溶液含有铝离子,C水溶液含有偏铝酸根,B为Al(OH)3,所以Al(OH)3与强碱反应生成偏铝酸根离子和水,反应离子方程式为:Al(OH)3 + OH— = AlO2— + 2H2O;正确答案:Al(OH)3 + OH— = AlO2— + 2H2O。
(2)X为常见黑色金属单质,X为铁,铁与稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式:Fe + 4H+ + NO3— = Fe3+ + NO↑ + 2H2O;正确答案:Fe + 4H+ + NO3— = Fe3+ +NO↑ +2H2O。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳。
①A为氢氧化钠,属于离子化合物,既含离子键又含共价键;正确答案:离子键、(极性)共价键。
②取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、100 mL容量瓶、胶头滴管等;正确答案:100mL容量瓶; 胶头滴管。
③100mL混合液中含有钠离子,浓度为0.5mol/L,钠离子的量为0.05mol;碳酸钠、碳酸氢钠混合物加热至恒重,固体为碳酸钠,根据钠离子守恒,所以碳酸钠为0.025 mol,质量为2.65 g;正确选项2.65。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。

根据判断出的元素回答问题:
(1)X的原子结构示意图为 ______________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______> ;比较g、h的最高价氧化物对应水化物的酸性强弱: >_______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O42H2O)难溶于水,工业上从废镍催化剂(主要成分是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
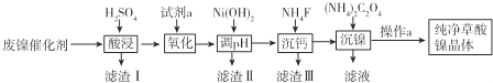
已知:①相关金属离子生成氢氧化物沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀.
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:______________________________________。
(2)试剂a是一种绿色氧化剂,写出氧化时反应的离子方程式:__________________________________。
(3)调节pH的范围为________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成:_____________。
(4)写出沉镍时反应的离子方程式:________________________________________________。证明Ni2+已经沉淀完全的实验步骤及现象是_____________________________________。当Ca2+沉淀完全时,溶液中c(F-)>________mol·L-1。
(5)操作a的内容是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:

(1)制得的乙酸乙酯在饱和碳酸钠溶液的_______层。(填“上”或“下”)
(2)浓硫酸的作用是______________。
(3)制取乙酸乙酯的化学方程式是___________,该反应属于______(填反应类型)反应。
(4)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和该性质的应用均正确的是
A. 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器盛装浓硫酸
B. SiO2不与任何酸反应,可用石英制造耐酸容器
C. ClO2具有还原性,可用于自来水的杀菌消毒
D. Al、Fe、Cu对应的氧化物均为碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将从大肠杆菌细胞中提取到的核酸彻底进行水解,直至形成不能再水解的小分子,则能得到的小分子的种类共有
A. 9种 B. 8种 C. 6种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
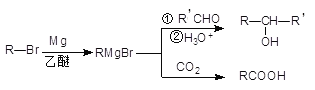
【题目】格林尼亚试剂简称“格氏试剂”,是有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得,在有机合成中用途广泛。反应原理如下:
由A( ![]() )合成 I (
)合成 I ( ![]() )的流程图:
)的流程图:
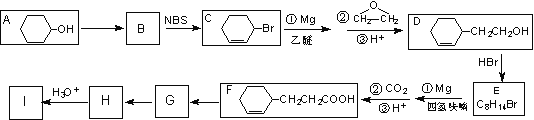
(已知:NBS为溴化试剂,在一定条件下能与烯烃作用生成溴代烯烃。)
(1) 物质A的名称为_________________;由A生成B的反应类型是_________;
(2) 写出由A制备 ![]() 的化学方程式_________________________;
的化学方程式_________________________;
(3) 四氢呋喃是一种优良的溶剂,可由呋喃( ![]() )加氢得到,则四氢呋喃的结构简式为_____________________;
)加氢得到,则四氢呋喃的结构简式为_____________________;
(4) 写出由G生成H的化学方程式_____________________________________;
(5) 写出符合下列要求的I的同分异构体的结构简式_____________________;(写出一种即可,同一碳上不能连接2个羟基)
① 芳香族化合物 ② 二元醇 ③ 分子中有5种化学环境的H
(6) 参照上述信息,以A和A制得的环己酮( ![]() )为原料合成
)为原料合成![]() (
(![]() )______________________。
)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在密闭容器中反应:2SO2+O22SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处. 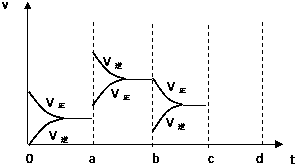
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com